Đáp án Hóa học 10 Cánh diều bài 7 Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
Đáp án bài 7 Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm. Bài giải được trình bày ngắn gọn, chính xác giúp các em học Hóa học 10 Cánh diều dễ dàng. Từ đó, hiểu bài và vận dụng vào các bài tập khác. Đáp án chuẩn chỉnh, rõ ý, dễ tiếp thu. Kéo xuống dưới để xem chi tiết
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
BÀI 7. XU HƯỚNG BIẾN ĐỔI MỘT SỐ TÍNH CHẤT CỦA ĐƠN CHẤT, BIẾN ĐỔI THÀNH PHẦN VÀ TÍNH CHẤT CỦA HỢP CHẤT TRONG MỘT CHU KÌ VÀ TRONG MỘT NHÓM
MỞ ĐẦU
Một hạt nhân có điện tích +Z sẽ hút electron bằng một lực với độ lớn ![]() , trong đó: r là khoảng cách từ hạt nhân tới electron, a là một hằng số. Hãy cho biết:
, trong đó: r là khoảng cách từ hạt nhân tới electron, a là một hằng số. Hãy cho biết:
a) Điện tích hạt nhân càng lớn thì lực hút electron càng mạnh hay càng yếu?
b) Khoảng cách giữa electron và hạt nhân càng lớn thì electron bị hạt nhân hút càng mạnh hay càng yếu?
Đáp án chuẩn:
a) Càng mạnh.
b) Càng yếu.
I. XU HƯỚNG BÁN KÍNH NGUYÊN TỬ
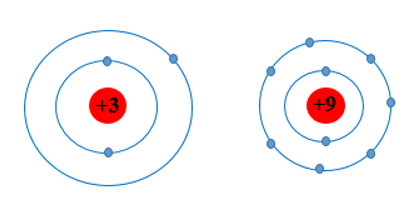
Câu hỏi 1: Các nguyên tố chu kì 2 có bao nhiêu lớp electron? Vẽ mô hình nguyên tử theo Rutherford – Bohr của Li và F để giải thích về sự khác biệt bán kính nguyên tử.
Đáp án chuẩn:
- Có 2 lớp.
- Mô hình nguyên tử Li và F:
Luyện tập 1:Quan sát hình 7.2, cho biết quy luật biến đổi bán kính nguyên tử của các nguyên tố ở chu kì 3, 4, 5 theo chiều tăng dần điện tích hạt nhân.
Đáp án chuẩn:
Bán kính nguyên tử giảm dần.
Luyện tập 2:Hãy giải thích vì sao nguyên tử He là nguyên tử nguyên tố có kích thước nhỏ nhất trong bảng tuần mà không phải là nguyên tử H.
Đáp án chuẩn:
Do nguyên tử He và H cùng thuộc chu kì 1, mà số đơn vị điện tích hạt nhân của He lớn hơn H.
II. XU HƯỚNG BIẾN ĐỔI ĐỘ ÂM ĐIỆN, TÍNH KIM LOẠI VÀ TÍNH PHI KIM
Câu hỏi 2: Dựa vào hình 7.5, hãy nhận xét quy luật chung về sự biến đổi độ âm điện của các nguyên tử nguyên tố nhóm A trong một chu kì, trong một nhóm.
Đáp án chuẩn:
Theo chiều tăng dần của điện tích hạt nhân thì:
- Trong một chu kì, tăng dần.
- Trong một nhóm, giảm dần.
Câu hỏi 3: Cặp electron liên kết của phân tử H2 có bị lệch về nguyên tử nào không? Vì sao?
Đáp án chuẩn:
Không bị lệch về nguyên tử nào do có hai nguyên tử H liên kết với nhau nên độ âm điện của hai nguyên tử bằng nhau.
Câu hỏi 4: Cặp electron liên kết bị lệch nhiều hơn trong phân tử NH3 hay trong phân tử H2O? Vì sao?
Đáp án chuẩn:
Lệch nhiều hơn trong H2O vì:
- Phân tử NH3 có N hút electron liên kết mạnh hơn H 1,36 lần.
- Phân tử H2O có O hút electron liên kết mạnh hơn H, 1,54 lần.
Luyện tập 3: Không dùng bảng độ âm điện hãy so sánh độ âm điện của các nguyên tố X có Z = 14 và nguyên tố Y có Z = 16. Giải thích.
Đáp án chuẩn:
Y lớn hơn X vì cả hai cùng thuộc chu kì 3 mà điện tích hạt nhân của Y lớn hơn.
Luyện tập 4: Giải thích nguyên nhân của quy luật biến đổi tính phi kim trong một chu kì, trong một nhóm.
Đáp án chuẩn:
- Trong một chu kì, từ trái sang phải, điện tích hạt nhân tăng dần, bán kính nguyên tử giảm dần nên lực hút của hạt nhân tới electron hóa trị tăng, làm tăng khả năng nhận electron nên tính phi kim của nguyên tố tăng dần.
- Trong một nhóm A, mặc dù điện tích hạt nhân tăng dần nhưng do bán kính nguyên tử của các nguyên tố tăng nhanh, nên lực hút của hạt nhân tới electron hóa trị giảm dần, làm giảm khả năng nhận thêm electron, nên tính phi kim giảm.
Luyện tập 5: Sắp xếp các nguyên tố sau theo chiều tăng dần tính phi kim: O, S, F. Giải thích.
Đáp án chuẩn:
F > O > S vì theo chiều tăng dần của điện tích hạt nhân thì:
- O và F thuộc cùng một chu kì nên F > O.
- O và S thuộc cùng một nhóm A nên O > S.
III. XU HƯỚNG BIẾN ĐỔI THÀNH PHẦN VÀ TÍNH ACID, TÍNH BASE CỦA CÁC OXIDE VÀ CÁC HYDROXIDE THEO CHU KÌ
Câu hỏi 5: Viết công thức oxide cao nhất của các nguyên tố chu kì 2, từ Li đến N.
Đáp án chuẩn:
- Li: Li2O
- Be: BeO
- B: B2O3
- C: CO2
- N: N2O5
Vận dụng: Giải thích vì sao không dùng chậu nhôm để đựng nước vôi tôi.
Đáp án chuẩn:
Do nước vôi tôi (Ca(OH)2) sẽ làm thủng chậu nhôm theo PTHH:
Al2O3 + Ca(OH)2 + 3H2O → Ca[Al(OH)4]2
2Al + Ca(OH)2 + 6H2O → Ca[Al(OH)4]2 + 3H2
Câu hỏi 6:Al(OH)3 thể hiện tính acid, tính base trong phản ứng nào trong ví dụ trên?
Đáp án chuẩn:
Tính acid: Al(OH)3 + NaOH → Na[Al(OH)4]
Tính base: Al(OH)3 + 3HCl → AlCl3 + 3H2O
Luyện tập 6: Xác định nguyên tố có tính kim loại mạnh nhất, nguyên tố có tính phi kim mạnh nhất. Giải thích.
Đáp án chuẩn:
Theo chiều tăng dần điện tích hạt nhân thì:
- Trong một chu kì và một nhóm A: kim loại mạnh nhất là Cs
- Trong một chu kì, một nhóm A: phi kim mạnh nhất là F.
Luyện tập 7: Viết công thức các hydroxide (nếu có) của những nguyên tố chu kì 2. So sánh tính acid, tính base của chúng.
Đáp án chuẩn:
- Li và Be là kim loại nên hydroxide của chúng là: LiOH và Be(OH)2.
- Tính acid của LiOH < Be(OH)2, tính base của LiOH > Be(OH)2.
BÀI TẬP
Bài 1: Hoàn thành chỗ trống trong các câu sau:
a) Trong một chu kì, theo chiều ...(1)... điện tích hạt nhân, độ âm điện của các nguyên tố có xu hướng tăng dần, tính base của các hydroxide của các nguyên tố có xu hướng ...(2)... dần.
b) Nhóm ...(3)... là nhóm chứa các nguyên tố đứng đầu mỗi chu kì trong bảng tuần hoàn. Trong nhóm này, nguyên tử nguyên tố ...(4)... có bán kính lớn nhất. Số lượng các nguyên tố là kim loại của nhóm này là ...(5)...
Đáp án chuẩn:
a) (1) tăng, (2) giảm
b) (3) kim loại kiềm, (4) Francium, (5) 6.
Bài 2: Những đặc trưng nào sau đây thuộc về kim loại nhóm A, những đặc trưng nào thuộc về phi kim?
(1) Dễ nhường electron
(2) Dễ nhận electron
(3) Oxide cao nhất có tính base
(4) Oxide cao nhất có tính acid
Đáp án chuẩn:
- Kim loại nhóm A: (1) và (3).
- Phi kim: (2) và (4).
Bài 3: Trong hai phản ứng sau, phản ứng nào xảy ra, phản ứng nào không xảy ra? Giải thích.
a) H3PO4 + Na2SO4 → ?
b) HNO3 + Na2CO3 → ?
Đáp án chuẩn:
Phản ứng a không xảy ra do H3PO4 là acid trung bình nên không đẩy được H2SO4 là acid mạnh ra khỏi muối.
Bài 4: Cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 như sau:
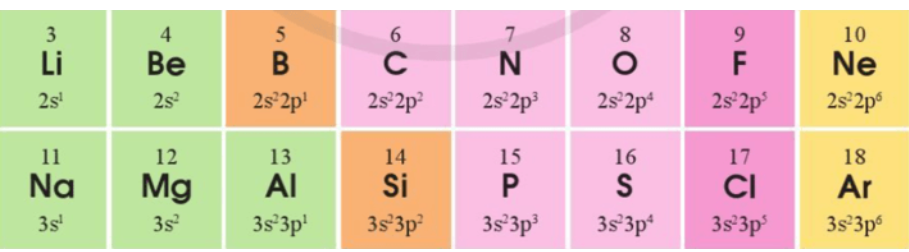
a) Sự lặp lại tuần hoàn về cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 thể hiện như thế nào?
b*) Giải thích vì sao sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng là nguyên nhân quyết định đến sự biến đổi tính tuần hoàn về tính chất hóa học của các đơn chất và hợp chất các nguyên tố chu kì 2 và 3. Lấy một số ví dụ để minh họa sự biến đổi đó.
Đáp án chuẩn:
a) Đi từ trái qua phải theo chiều tăng dần điện tích hạt nhân nguyên tử, số electron lớp ngoài cùng tăng dần từ 1 đến 8.
b*) - Vì với các nguyên tố chu kỳ 2 và 3 electron hóa trị tham gia vào việc hình thành liên kết hóa học cũng là electron ở lớp ngoài cùng.
- Ví dụ:
+ Trong chu kì 2, theo chiều từ trái sang phải, tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim tăng dần.
+ Trong chu kì 2, theo chiều tăng của điện tích hạt nhân, tính acid của oxide cao nhất có xu hướng tăng và tính base có xu hướng giảm dần.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận