Soạn giáo án điện tử hóa học 11 KNTT Bài 7: Sulfur và sulfur dioxide
Giáo án powerpoint hóa học 11 kết nối tri thức mới. Giáo án soạn theo tiêu chí hiện đại, đẹp mắt với nhiều hình ảnh, nội dung, hoạt động phong phú, sáng tạo. Giáo án điện tử này dùng để giảng dạy online hoặc trình chiếu. Tin rằng, bộ bài giảng này sẽ hỗ trợ tốt việc giảng dạy và đem đến sự hài lòng với thầy cô.
Xem hình ảnh về giáo án











Còn nữa....Giáo án khi tải về là bản đầy đủ. Có full siles bài giảng!
Nội dung giáo án
CHÀO MỪNG CÁC EM ĐẾN VỚI BÀI HỌC MỚI
KHỞI ĐỘNG
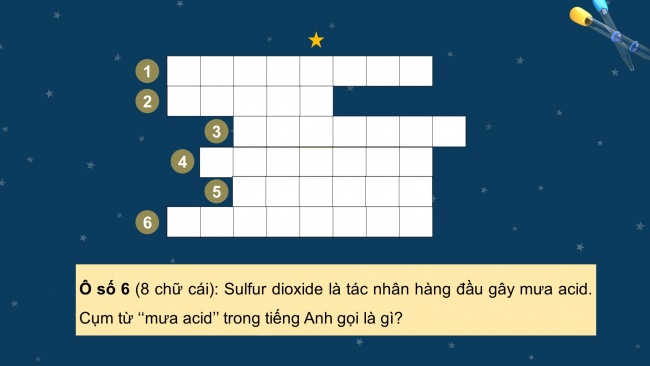
Luật chơi:
- Có 8 từ hàng ngang tương ứng với 8 câu hỏi gợi ý bất kỳ.
- Các em dựa vào gợi ý và tìm từ hàng ngang tương ứng với số ô chữ của mỗi hàng.
- Sau khi lật mở hết từ hàng ngang, em hãy đọc từ hàng dọc xuất hiện trong trò chơi.
Ô số 1 (8 chữ cái): Tên dân gian dùng để gọi vị thuốc đông y có thành phần chính là sulfur?
Ô số 2 (5 chữ cái): Vật liệu có tính đàn hồi?
Ô số 3 (7 chữ cái): Tên gọi của ion S2- theo IUPAC là gì?
Ô số 4 (7 chữ cái): Tên gọi của uon theo IUPAC là gì?
Ô số 5 (6 chữ cái): Trong công nghiệp, quá trình sử dụng sulfur làm chất phụ gia giúp tăng độ bền, chống mài mòn cho cao su gọi là gì?
Ô số 6 (8 chữ cái): Sulfur dioxide là tác nhân hàng đầu gây mưa acid. Cụm từ ‘‘mưa acid’’ trong tiếng Anh gọi là gì?
BÀI 7
SUNFUR VÀ SUNFUR DIOXIDE
NỘI DUNG BÀI HỌC
Sunfur
Sunfur dioxide
- SUNFUR
- Trạng thái tự nhiên
Hoạt động nhóm: Tìm hiểu về trạng thái tự nhiên của sunfur
- Các dạng tồn tại của nguyên tố sulfur trên vỏ Trái Đất, nêu ứng dụng chính của một số hợp chất quan trọng.
- Hàm lượng nguyên tố sulfur trong cơ thể người, xác định khối lượng nguyên tố sulfur trong cơ thể dựa theo cân nặng.
- Các đồng vị tự nhiên của nguyên tố sulfur.
Nhận xét
Nguyên tố lưu huỳnh tồn tại trong tự nhiên ở cả dạng đơn chất (mỏ sulfur) và dạng hợp chất (quặng sulfide, sulfate,..).
- Cấu tạo nguyên tử, phân tử
Nêu những số oxi hóa của sulfur? Xác định số oxi hóa của sulfur trong các hợp chất H2S, SO2, SO3?
Xác định ô, nhóm, chu kì của nguyên tố sulfur? Sulfur có tính kim loại hay phi kim?
Cấu tạo nguyên tử
- Nguyên tố sulfur ở ô số 16, nhóm VIA, chu kì 3 trong bảng tuần hoàn và có tính phi kim.
- Sulfur có các số oxi hóa khác nhau từ - 2 đến +6.
- Ví dụ:
Nêu cấu tạo phân tử sulfur (gồm mấy nguyên tử? dạng gì?)
Mỗi nguyên tử sulfur liên kết với hai nguyên tử bên cạnh bằng liên kết gì?
Trong các phản ứng hóa học, phân tử sulfur thường được viết như thế nào?
- Phân tử sulfur gồm 8 nguyên tử (S8) có dạng vòng khép kín.
- Mỗi nguyên tử sulfur liên kết với hai nguyên tử bên cạnh bằng hai liên kết cộng hóa trị không phân cực.
- Trong phản ứng hóa học, phân tử sulfur được viết đơn giản là S.
Hình 7.3. Phân tử sulfur S8
Câu hỏi 1 HĐ I.2 (SGK tr.43). Viết cấu hình electron của nguyên tử S (Z = 16) và biểu diễn sự phân bố electron vào các ô orbital.
- Cấu hình electron nguyên tử sulfur:
1s22s22p63s23p4 hay [Ne]3s23p4
- Biểu diễn sự phân bố electron ở lớp ngoài cùng của nguyên tử S vào các orbital:
Câu hỏi 2 HĐ I.2 (SGK tr.43). Dựa vào cấu hình electron và độ âm điện của nguyên tử S, hãy đưa ra dự đoán về:
- a) Số oxi hóa thấp nhất, cao nhất của nguyên tử S trong hợp chất.
- b) Tính oxi hóa, tính khử của sulfur.
- a) Nguyên tử sulfur có 6 electron lớp ngoài cùng nên có xu hướng nhận thêm 2 electron từ kim loại để tạo thành ion sulfide:
S + 2e S2-
Tương tự, nguyên tử sulfur cũng có xu hướng dùng chung electron với nguyên tử phi kim để tạo liên kết cộng hóa trị
- b) Trên trục biểu diễn số oxi hóa, nguyên tử S trong đơn chất có số oxi hóa bằng 0:
> Là số oxi hóa trung gian nên thể hiện được cả tính oxi hóa (nhận electron để giảm số oxi hóa) và tính khử (nhường electron để tăng tính oxi hóa).
- Tính chất vật lí
- Đơn chất sulfur có mấy dạng thù hình? Đó là những dạng nào?
- Nêu độ tan của sulfur trong nước, alcohol và carbon disulfide.
Đơn chất sunfur
Có hai dạng thù hình: dạng tà phương (bền ở nhiệt độ thường) và dạng đơn tà
Không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide
- Tính chất hoá học
Thực hiện thí nghiệm chứng minh sulfur đơn chất vừa có tính oxi hóa, vừa có tính khử và hoàn thành Phiếu học tập.
- Tác dụng với hydrogen và kim loại
Thí nghiệm : Sulfur tác dụng với sắt (iron)
Chuẩn bị
- Bột sulfur, bột iron, ống nghiệm, kẹp gỗ, đèn cồn, bông.
Tiến hành
- Trộn đều bột sulfur với bột iron theo tỉ lệ khối lượng khoảng 1 : 1,5.
- Lấy khoảng 2 g hỗn hợp vào ống nghiệm khô chịu nhiệt, dùng bông nút miệng ống nghiệm.
- Hơ nóng đều nửa dưới ống nghiệm trên ngọn lửa đèn cồn, sau đó đun tập trung vào phần chứa hỗn hợp.
Dự đoán sản phẩm tạo thành sau thí nghiệm, viết phương trình hóa học của phản ứng và xác định chất oxi hóa, chất khử?
Nâng cấp lên tài khoản VIP để tải tài liệu và dùng thêm được nhiều tiện ích khác
Xem thêm giáo án khác
GIÁO ÁN TỰ NHIÊN 11 KẾT NỐI TRI THỨC
Giáo án Toán 11 kết nối tri thức
Giáo án điện tử toán 11 kết nối tri thức
Giáo án Vật lí 11 kết nối tri thức
Giáo án điện tử vật lí 11 kết nối tri thức
Giáo án Hóa học 11 kết nối tri thức
Giáo án điện tử Hóa học 11 kết nối tri thức
Giáo án Sinh học 11 kết nối tri thức
Giáo án điện tử Sinh học 11 kết nối tri thức
Giáo án Công nghệ cơ khí 11 kết nối tri thức
Giáo án điện tử Công nghệ cơ khí 11 kết nối tri thức
Giáo án Công nghệ chăn nuôi 11 kết nối tri thức
Giáo án điện tử Công nghệ chăn nuôi 11 kết nối tri thức
Giáo án Tin học ứng dụng 11 kết nối tri thức
Giáo án điện tử Tin học ứng dụng 11 kết nối tri thức
Giáo án Khoa học máy tính 11 kết nối tri thức
Giáo án điện tử Khoa học máy tính 11 kết nối tri thức
GIÁO ÁN XÃ HỘI 11 KẾT NỐI TRI THỨC
Giáo án Ngữ văn 11 kết nối tri thức
Giáo án điện tử ngữ văn 11 kết nối tri thức
Giáo án Lịch sử 11 kết nối tri thức
Giáo án điện tử Lịch sử 11 kết nối tri thức
Giáo án Địa lí 11 kết nối tri thức
Giáo án điện tử địa lí 11 kết nối tri thức
Giáo án Kinh tế pháp luật 11 kết nối tri thức
Giáo án điện tử Kinh tế pháp luật 11 kết nối tri thức
GIÁO ÁN LỚP 11 CÁC MÔN CÒN LẠI
Giáo án Hoạt động trải nghiệm 11 kết nối tri thức
Giáo án điện tử Hoạt động trải nghiệm 11 kết nối tri thức
GIÁO ÁN LỚP 11 BỘ SÁCH KHÁC
Giáo án tất cả các môn lớp 11 cánh diềuGiáo án tất cả các môn lớp 11 chân trời sáng tạo
