Vì sao góc liên kết HCH trong phân tử methane không thể là 90o?
3. Sự lai hoá obital nguyên tử
Câu hỏi 9: Vì sao góc liên kết HCH trong phân tử methane không thể là 90o?
Câu hỏi 10: Em có nhận xét gì về hình dạng, kích thước, năng lượng và hướng của các orbital nguyên tử lai hóa?
Câu hỏi 11: Nếu tổng số các AO tham gia lai hóa là 3 sẽ tạo ra bao nhiêu AO lai hóa?
Câu hỏi 12: Nguyên tử carbon trong phân tử CO2 ở trạng thái lai hóa nào? Giải thích liên kết hóa học tạo thành trong phân tử CO2 theo thuyết lai hóa.
Câu hỏi 13: Theo mô hình VSEPR, phân tử formaldehyde có dạng tam giác phẳng. Xác định trạng thái lai hóa của nguyên tử trung tâm carbon. Cho biết formaldehyde có công thức như hình sau đây:
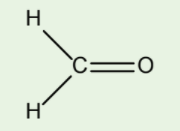
Câu hỏi 14: Tương tự như công thức VSEPR, có thể dự đoán nhanh trạng thái lai hóa của nguyên tử A (nguyên tố s, p) trong một phân tử bất kì như sau:
- Xác định số nguyên tử liên kết trực tiếp với A.
- Xác định số cặp electron hóa trị riêng của A.
- Nếu tổng hai giá trị là 2; 3 hoặc 4 thì trạng thái lai hóa của A lần lượt là sp; sp2 hoặc sp3
Dự đoán trạng thái lai hóa của nguyên tử C, S và N trong các phân tử CO2, SO2 và NH3
Câu hỏi 15: Phân tử chứa nguyên tử lai hóa sp3 có cấu trúc phẳng không? Giải thích và cho ví dụ.
Câu hỏi luyện tập: Biết nguyên tử oxygen trong phân tử H2O ở trạng thái lai hóa sp3. Trình bày sự hình thành liên kết hóa học trong phân tử H2O
Câu hỏi 9:
Vì xung quanh nguyên tử C có 4 cặp electron chung. Để giảm tối đa lực đẩy giữa 4 cặp electron chung, 4 cặp electron này phải chiếm 4 khu vực điện tích âm sao cho lực đẩy giữa chúng là nhỏ nhất nên phân tử có dạng tứ diện, góc liên kết HCH = 109,5o
Câu hỏi 10:
Các orbital nguyên tử lai hóa có năng lượng bằng nhau, hình dạng, kích thước giống nhau.
Câu hỏi 11:
Số AO lai hóa bằng tổng số AO tham gia lai hóa nên nếu có 3 AO tham gia lai hóa sẽ tạo ra 3 AO lai hóa.
Câu hỏi 12:
Công thức Lewis của CO2 là: ![]()
Công thức VSEPR của CO2 có dạng AX2
Từ công thức Lewis của CO2 ta xác định được phân tử này có dạng đường thẳng theo mô hình VSEPR.
Cấu hình electron của C (Z = 6) là 1s22s22p2.
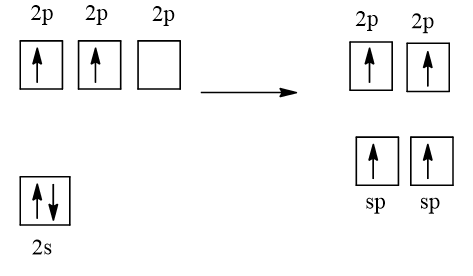
1 AO 2s tổ hợp với 1 AO 2p, tạo 2 AO lai hóa sp
2 AO lai hóa này xen phủ trục với 2 AO 2p chứa electron độc thân của 2 nguyên tử O tạo thành liên kết σ.
Hai AO 2p không lai hóa của nguyên tử C có chứa electron độc thân xen phủ bên với 2AO 2p chứa electron độc thân còn lại của 2 nguyên tử O, tạo nên 2 liên kết π.
Câu hỏi 13:
Cấu hình electron của C (Z = 6) là 1s22s22p2.

1 AO 2s tổ hợp với 2 AO 2p tạo 3 AO lai hóa sp2.
Vậy nguyên tử C trong phân tử formaldehyde lai hóa sp2
Câu hỏi 14:
Trong phân tử CO2
- Số nguyên tử liên kết với C là 2.
- Số cặp electron hóa trị riêng của C là 0
- Tổng hai giá trị là 2 ⇒ Trạng thái lai hóa của C là sp.
Trong phân tử SO2
- Số nguyên tử liên kết với S là 2.
- Số cặp electron hóa trị riêng của S là 1
- Tổng hai giá trị là 3 ⇒ Trạng thái lai hóa của S là sp2.
Trong phân tử NH3
- Số nguyên tử liên kết với N là 3.
- Số cặp electron hóa trị riêng của N là 1
- Tổng hai giá trị là 4 ⇒ Trạng thái lai hóa của N là sp3.
Câu hỏi 15:
Phân tử chứa nguyên tử lai hóa sp3 không thể có cấu trúc phẳng. Vì khi 1 AO ns tổ hợp với 3 AO np tạo ra 4 AO lai hóa sp3. 4 AO sp3 này chiếm 4 khu vực điện tích âm sao cho lực đẩy giữa chúng là nhỏ nhất nên phân tử có dạng tứ diện, góc tạo bởi hai trục của hai AO là 109,5o.
Ví dụ phân tử CH4
Từ công thức Lewis của CH4 ta xác định được phân tử này có dạng tứ diện theo mô hình VSEPR.
Cấu hình electron của C (Z = 6) là 1s22s22p2
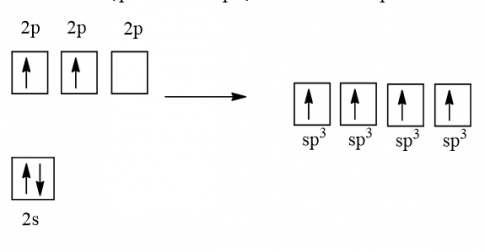
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
4 AO lai hóa sp3 của nguyên tử C xen phủ với 4 AO s của nguyên tử H tạo thành 4 liên kết σ hướng về 4 đỉnh của một tứ diện đều.
Câu hỏi luyện tập:
Cấu hình electron của O (Z = 8) là 1s22s22p4
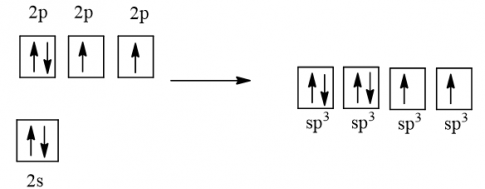
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
2 AO lai hóa sp3 chứa electron độc thân của nguyên tử O xen phủ với 2 AO s của nguyên tử H tạo thành 2 liên kết σ.

Bình luận