Câu hỏi tự luận mức độ vận dụng Hóa học 12 kntt bài 20: Kim loại trong tự nhiên và phương pháp tách kim loại
3. VẬN DỤNG (5 CÂU)
Câu 1: Từ những hợp chất riêng biệt : Cu(OH)2, MgO, FeS2, hãy nêu phương pháp thích hợp để điều chế Cu, Mg, Fe.
Câu 2: Bằng những phương pháp nào người ta có thể điều chế Cu từ dung dịch Cu(NO3)2, Ca từ dung dịch CaCl2? Viết phương trình hoá học của các phản ứng.
Câu 3: Một loại quặng sắt chứa 80% Fe2O3 và 10% SiO2. Hàm lượng các nguyên tử Fe và Si trong quặng này là bao nhiêu?
Câu 4: Để khử hoàn toàn 30 gam hỗn hợp gồm CuO, FeO, Fe3O4, Fe2O3,Fe, MgO cần dùng 5,6 lít khí CO (đktc). Khối lượng chất rắn thu được sau phản ứng là bao nhiêu?
Câu 5: Chu sa còn gọi là cinnabar, là một loại khoáng vật có thành phần chính là HgS. Trước đây, trong y học cổ truyền, chu sa được dùng với liều lượng phù hợp kết hợp với một số vị thuốc khác trong điều trị chứng mất ngủ, tim đập loạn, hồi hộp. Tuy nhiên, vị thuốc này chỉ được “dùng sống”, tuyệt đối không nấu (không sắc thuốc) hoặc dùng lửa (nướng, đốt). Hãy tìm hiểu và lí giải cho việc không dùng nhiệt đối với chu sa, viết phương trình hoá học của phản ứng xảy ra (nếu có).
Câu 1:
Phương pháp:
Cu(OH)2 → CuCl2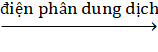 Cu.
Cu.
MgO → MgCl2 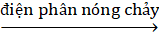 Mg.
Mg.
FeS2 → Fe2O3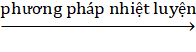 Fe.
Fe.
Câu 2:
- Điều chế Cu từ Cu(NO3)2:
2Cu(NO3)2 + 2H2O 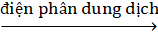 2Cu + O2 + 4HNO3
2Cu + O2 + 4HNO3
CuO + H2 ![]() Cu + H2O.
Cu + H2O.
- Điều chế Ca từ CaCl2: cô cạn dung dịch CaCl2 rồi điện phân nóng chảy.
CaCl2 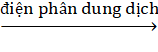 Ca + Cl2
Ca + Cl2
Câu 3:
Giả sử có 100 gam quặng sắt, khối lượng Fe2O3 là 80 gam và khối lượng SiO2 là 10 gam
Số mol Fe2O3 là 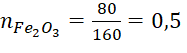 (mol)
(mol)
![]() (mol)
(mol)
→ mFe = 56(g)
%mFe = 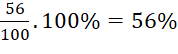 .
.
![]()
Tương tự tính cho Si , %mSi = 4,7%
Câu 4:
nCO = 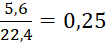 mol.
mol.
Áp dụng định luật bảo toàn khối lượng ta có:
![]() (gam).
(gam).
Câu 5:
Muối HgS dễ bị phân huỷ, cháy khi đun nóng hoặc tiếp xúc với lửa, sinh ra hơi thuỷ ngân rất độc. Trong thực tế, trước đây người ta dùng đá chu sa như một nguồn chủ yếu để sản xuất kim loại thuỷ ngân, người ta đốt cháy chu sa trong ống kín, ngưng tụ sản phẩm cháy thu được thuỷ ngân dạng lỏng.
HgS(s) → Hg(s) + S(s)
HgS(s) + O2(g) → Hg(g) + SO2(g).
Giải những bài tập khác
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận