Câu hỏi tự luận mức độ thông hiểu Hóa học 12 kntt bài 28: Sơ lược về phức chất
2. THÔNG HIỂU (5 CÂU)
Câu 1: Từ công thức Lewis của NH3, giải thích vì sao phân tử này có thể đóng vai trò là phối tử?
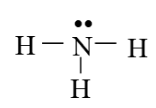
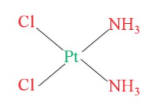
Câu 2: Hãy chỉ ra nguyên tử trung tâm và phối tử trong phức chất sau:
Câu 3: Vì sao AgCl không phải là phức chất trong khi cation [H3N-Ag-NH3]+ là phức chất?
Câu 4: Vì sao sodium chloride (NaCl) không phải là một phức chất?
Câu 5: Vì sao 1 phân tử H2O hoặc 1 phân tử H2N-CH2-NH2 hay 1 ion F- chỉ sử dụng được một cặp electron hoá trị riêng để tạo liên kết với cation kim loại trong quá trình hình thành phức chất?
Câu 1:
Từ công thức Lewis của NH3, ta thấy phân tử NH3 còn một cặp electron chưa tham gia liên kết. Cặp electron chưa tham gia liên kết này có thể tạo liên kết cho nhận với orbital trống của nguyên tử trung tâm tạo phức chất.
Do đó phân tử NH3 có thể đóng vai trò là phối tử.
Câu 2:
Nguyên tử trung tâm là Pt2+, phối tử là Cl và NH3.
Câu 3:
Trong phức chất thì liên kết giữa nguyên tử trung tâm và phối tử là liên kết cho nhận ⇒⇒ AgCl không có liên kết cho – nhận nên không phải phức chất còn cation [H3N–Ag–NH3]+ có liên kết cho – nhận nên là phức chất.
Câu 4:
Trong phức chất thì liên kết giữa nguyên tử trung tâm và phối tử là liên kết cho nhận ⇒NaCl không có liên kết cho – nhận nên không phải phức chất.
Câu 5:
Trong một phân tử hoặc một anion, các cặp electron hoá trị càng gần nhau có xu hướng đẩy nhau. Vì vậy, thường chỉ 1 cặp electron hoá trị riêng trong chúng tạo được 1 liên kết bền với cation kim loại trong quá trình tham gia tạo phức chất.
Giải những bài tập khác
Giải bài tập những môn khác
Môn học lớp 12 KNTT
5 phút giải toán 12 KNTT
5 phút soạn bài văn 12 KNTT
Văn mẫu 12 KNTT
5 phút giải vật lí 12 KNTT
5 phút giải hoá học 12 KNTT
5 phút giải sinh học 12 KNTT
5 phút giải KTPL 12 KNTT
5 phút giải lịch sử 12 KNTT
5 phút giải địa lí 12 KNTT
5 phút giải CN lâm nghiệp 12 KNTT
5 phút giải CN điện - điện tử 12 KNTT
5 phút giải THUD12 KNTT
5 phút giải KHMT12 KNTT
5 phút giải HĐTN 12 KNTT
5 phút giải ANQP 12 KNTT
Môn học lớp 12 CTST
5 phút giải toán 12 CTST
5 phút soạn bài văn 12 CTST
Văn mẫu 12 CTST
5 phút giải vật lí 12 CTST
5 phút giải hoá học 12 CTST
5 phút giải sinh học 12 CTST
5 phút giải KTPL 12 CTST
5 phút giải lịch sử 12 CTST
5 phút giải địa lí 12 CTST
5 phút giải THUD 12 CTST
5 phút giải KHMT 12 CTST
5 phút giải HĐTN 12 bản 1 CTST
5 phút giải HĐTN 12 bản 2 CTST
Môn học lớp 12 cánh diều
5 phút giải toán 12 CD
5 phút soạn bài văn 12 CD
Văn mẫu 12 CD
5 phút giải vật lí 12 CD
5 phút giải hoá học 12 CD
5 phút giải sinh học 12 CD
5 phút giải KTPL 12 CD
5 phút giải lịch sử 12 CD
5 phút giải địa lí 12 CD
5 phút giải CN lâm nghiệp 12 CD
5 phút giải CN điện - điện tử 12 CD
5 phút giải THUD 12 CD
5 phút giải KHMT 12 CD
5 phút giải HĐTN 12 CD
5 phút giải ANQP 12 CD
Giải chuyên đề học tập lớp 12 kết nối tri thức
Giải chuyên đề Ngữ văn 12 Kết nối tri thức
Giải chuyên đề Toán 12 Kết nối tri thức
Giải chuyên đề Vật lí 12 Kết nối tri thức
Giải chuyên đề Hóa học 12 Kết nối tri thức
Giải chuyên đề Sinh học 12 Kết nối tri thức
Giải chuyên đề Kinh tế pháp luật 12 Kết nối tri thức
Giải chuyên đề Lịch sử 12 Kết nối tri thức
Giải chuyên đề Địa lí 12 Kết nối tri thức
Giải chuyên đề Tin học ứng dụng 12 Kết nối tri thức
Giải chuyên đề Khoa học máy tính 12 Kết nối tri thức
Giải chuyên đề Công nghệ 12 Điện - điện tử Kết nối tri thức
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Kết nối tri thức
Giải chuyên đề học tập lớp 12 chân trời sáng tạo
Giải chuyên đề Ngữ văn 12 Chân trời sáng tạo
Giải chuyên đề Toán 12 Chân trời sáng tạo
Giải chuyên đề Vật lí 12 Chân trời sáng tạo
Giải chuyên đề Hóa học 12 Chân trời sáng tạo
Giải chuyên đề Sinh học 12 Chân trời sáng tạo
Giải chuyên đề Kinh tế pháp luật 12 Chân trời sáng tạo
Giải chuyên đề Lịch sử 12 Chân trời sáng tạo
Giải chuyên đề Địa lí 12 Chân trời sáng tạo
Giải chuyên đề Tin học ứng dụng 12 Chân trời sáng tạo
Giải chuyên đề Khoa học máy tính 12 Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Điện - điện tử Chân trời sáng tạo
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Chân trời sáng tạo
Giải chuyên đề học tập lớp 12 cánh diều
Giải chuyên đề Ngữ văn 12 Cánh diều
Giải chuyên đề Toán 12 Cánh diều
Giải chuyên đề Vật lí 12 Cánh diều
Giải chuyên đề Hóa học 12 Cánh diều
Giải chuyên đề Sinh học 12 Cánh diều
Giải chuyên đề Kinh tế pháp luật 12 Cánh diều
Giải chuyên đề Lịch sử 12 Cánh diều
Giải chuyên đề Địa lí 12 Cánh diều
Giải chuyên đề Tin học ứng dụng 12 Cánh diều
Giải chuyên đề Khoa học máy tính 12 Cánh diều
Giải chuyên đề Công nghệ 12 Điện - điện tử Cánh diều
Giải chuyên đề Công nghệ 12 Lâm nghiệp thủy sản Cánh diều

Bình luận