Lý thuyết trọng tâm hóa học 11 kết nối bài 4: Nitrogen
Tổng hợp kiến thức trọng tâm hóa học 11 kết nối bài 4: Nitrogen. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. TRẠNG THÁI TỰ NHIÊN
Ở trạng thái tự nhiên, nitrogen tồn tại ở dạng đơn chất và hợp chất:
- Dạng đơn chất: 78% thể tích không khí; trong tự nhiên là hỗn hợp 2 đồng vị $^{14}$N (99,63%) và $^{15}$N (0,37%)
- Dạng hợp chất: trong khoáng vật sodium nitrate (diêm tiêu Chile); thành phần protein, nucleic acid.
II. CẤU TẠO NGUYÊN TỬ VÀ PHÂN TỬ
1. Cấu tạo nguyên tử
- Nguyên tố nitrogen ở ô số 7, nhóm VA, chu kì 2 trong bảng tuần hoàn, có độ âm điện lớn
- Các số oxi hóa thường gặp của nitrogen: 3; 0; + 1; + 2; + 3; + 4; +5
2. Cấu tạo phân tử
Phân tử nitrogen gồm hai nguyên tử, liên kết với nhau bằng liên kết ba (1 liên kết và 2 liên kết ); năng lượng liên kết lớn và không có cực
Công thức Lewis của phân tử nitrogen: :N≡N:
Nếu coi hai nguyên tử nitrogen không ở trạng thái lai hóa sp:
- 1 liên kết tạo thành nhờ sự xen phủ dọc theo trục liên kết của cặp orbital 2p$_{z}$–2p$_{z}$
- 2 liên kết tạo thành nhờ sự xen phủ bên của các cặp orbital 2p$_{x}$–2p$_{x}$ và 2p$_{y}$–2p$_{y}$

Phân tử nitrogen có liên kết ba bền vững, khó bị phá vỡ để tạo liên kết mới nên nitrogen khá trơ ở nhiệt độ thường
II. TÍNH CHẤT VẬT LÍ
- Ở điều kiện thường, nitrogen là chất khí, không màu, không mùi, không vị, khó hòa tan, tan rất ít trong nước.
- Khí nitrogen không duy trì sự cháy và sự hô hấp
- Phân tử nitrogen nhẹ và không phân cực, tương tác van der Waals giữa các phân tử nitrogen rất yếu nên khó hóa lỏng
- Tương tác van der Waals giữa các phân tử nitrogen với nước rất yếu nên ít tan trong nước
IV. TÍNH CHẤT HÓA HỌC
1. Tác dụng với hydrogen
$N_{2}(g)+3H_{2}(g)\overset{t^{o},p,xt}{\rightleftharpoons }2NH_{3}(g)$
2. Tác dụng với oxygen
$N_{2}(g)+O_{2}(g)\overset{t^{o}}{\rightleftharpoons }2NO(g)$
Quá trình tạo và cung cấp đạm nitrate cho đất từ nước mưa được biểu diễn theo sơ đồ:
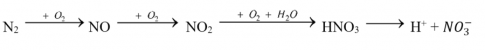
V. ỨNG DỤNG
Một số ứng dụng của nitrogen:
- Tác nhân làm lạnh
- Tổng hợp ammonia
- Tạo khí quyển trơ
- Bảo quản thực phẩm
Nitrogen có nhiều ứng dụng trong sản xuất và đời sống
- Ứng dụng quan trọng nhất của khí nitrogen là để tổng hợp ammonia, mắt xích trung gian để sản xuất nitric acid, muối nitrate và nhiều hợp chất khác
- Trong nghiên cứu, khí nitrogen được dùng tạo bầu khí quyển trơ do phân tử nitrogen rất bền nhiệt
- Trong y học, nitrogen lỏng được dùng tạo môi trường lạnh sâu để bảo quản mẫu vật phẩm. Nitrogen lỏng với độ lạnh sâu cũng đóng băng mô ngay khi tiếp xúc nên được dùng điều trị mụn cóc và một số bệnh ngoài da
- Trong công nghiệp thực phẩm, nitrogen lỏng được phun vào vỏ bao bì trước khi đóng nắp nitrogen biến thành thể khí làm căng vỏ bao bì, vừa bảo vệ thực phẩm khi có va chạm, vừa bảo quản hương vị thực phẩm.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận