Lý thuyết trọng tâm hóa học 11 kết nối bài 2: Cân bằng trong dung dịch nước
Tổng hợp kiến thức trọng tâm hóa học 11 kết nối bài 2: Cân bằng trong dung dịch nước. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. SỰ ĐIỆN LI
1. Hiện tượng điện li
- Dòng điện là dòng chuyển dời có hướng của các hạt mang điện
- Trong dung dịch muối ăn có ion âm (anion) và ion dương (cation)
- NaCl là tinh thể ion, trong tinh thể có ion Na$^{+}$ liên kết với ion Cl$^{-}$, dưới tác dụng của phân tử nước phân cực, tinh thể ion bị phá vỡ và tạo thành các ion Na$^{+}$ và Cl$^{-}$ trong dung dịch, vì vậy dung dịch muối ăn dẫn điện
=> Kết luận: Quá trình phân li các chất trong nước tạo thành ion được gọi là sự điện li. Những chất khi tan trong nước phân li ra các ion được gọi là chất điện li
2. Chất điện li
a) Chất điện li và chất không điện li
Dung dịch HCl | Dung dịch NaOH | Dung dịch saccharose | Dung dịch ethanol | |
Hiện tượng | Đèn sáng | Đèn sáng | Đèn không sáng | Đèn không sáng |
Dung dịch dẫn điện/không dẫn điện | Dung dịch dẫn điện | Dung dịch dẫn điện | Dung dịch không điện | Dung dịch không dẫn điện |
Có/không có các ion trái dấu trong dung dịch | Có | Có | Không | Không |
Chất điện li/chất không điện li | Chất điện li | Chất điện li | Chất không điện li | Chất không điện li |
=> Kết luận:
- Các acid, base, muối khi hòa tan trong nước phân li ra các ion nên chúng là chất điện li.
- Nước tinh khiết, đường và ethanol trong nước không phân li ra các ion nên chúng là chất không điện li.
Cách viết phương trình điện li:
- Acid ⟶ H$^{+}$ + anion gốc acid
- Base ⟶ cation kim loại/ $NH_{4}^{+}$ + OH$^{-}$
- Muối ⟶ cation kim loại/ $NH_{4}^{+}$ + anion gốc acid
Ví dụ: $Na_{2}CO_{3}\rightarrow 2Na^{+}+CO_{3}^{2-}$
$H_{2}SO_{4}\rightarrow 2H^{+}+SO_{4}^{2-}$
$Ba(OH)_{2}\rightarrow Ba^{2+}+2OH^{-}$
Dựa vào mức độ phân li thành các ion, chất điện li được chia thành hai loại:
Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion.
Các chất điện li mạnh thường gặp:
- Acid mạnh: HCl, HNO$_{3}$, H$_{2}$SO$_{4}$,...
- Base mạnh: NaOH, KOH, Ca(OH)$_{2}$, Ba(OH)$_{2}$,...
- Hầu hết các muối
Quá trình phân li của chất điện li mạnh xảy ra gần như hoàn toàn và được biểu diễn bằng mũi tên một chiều.
- $HNO_{3}\rightarrow H^{+}+NO_{3}^{-}$
- $NaOH\rightarrow Na^{+}+OH^{-}$
- $Na_{2}CO_{3}\rightarrow 2Na^{+}+CO_{3}^{2-}$
Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch
Những chất điện li yếu gồm các acid yếu như CH$_{3}$COOH, HClO, HF, H$_{2}$CO$_{3}$,... và các base yếu như Cu(OH)$_{2}$, Fe(OH)$_{2}$,...
Quá trình phân li của chất điện li yếu là một phản ứng thuận nghịch và được biểu diễn bằng hai nửa mũi tên ngược chiều nhau:
CH$_{2}$COOH ⇌ H$^{+}$ + CH$_{2}$COO$^{-}$
Phương trình phản ứng dạng phân tử và dạng ion rút gọn của phản ứng xảy ra giữa dung dịch $Na_{2}CO_{3}$ và dung dịch HCl:
- Phương trình phân tử:
$Na_{2}CO_{3}+2HCl\rightarrow 2NaCl+CO_{2}+H_{2}O$
- Phương trình ion đầy đủ:
$2Na^{+}+CO_{3}^{2-}+2H^{+}+2Cl^{-}\rightarrow 2Na^{+}+2Cl^{-}+CO_{2}+H_{2}O$
- Phương trình ion rút gọn:
$2H^{+}+CO_{3}^{2-}\rightarrow CO_{2}+H_{2}O$
II. THUYẾT AXID – BASE CỦA BR∅NSTED - LOWRY
1. Khái niệm acid và base theo thuyết Br∅nsted - Lowry
a) Phương trình điện li:
- $HCl\rightarrow H^{+}+Cl^{-}$
- $NaOH\rightarrow Na^{+}+OH^{-}$
- $Na_{2}CO_{3}\rightarrow 2Na^{+}+CO_{3}^{2-}$
b) Dung dịch HCl có môi trường acid (pH < 7), còn dung dịch NaOH và Na2CO3 có môi trường base (pH > 7)
c) Theo định nghĩa acid – base đã học ở môn Khoa học tự nhiên lớp 8, HCl là acid, NaOH là base, còn $Na_{2}CO_{3}$ không là base
Kết luận:
- Khái niệm acid – base đề cập ở lớp 8 chỉ đúng với dung môi nước và chưa phản ánh đầy đủ bản chất acid/base.
- Thuyết Br∅nsted – Lowry cho rằng acid là chất cho proton (H$^{+}$) và base là chất nhận proton
2. Ưu điểm của thuyết Br∅nsted – Lowry
Thuyết Br∅nsted – Lowry tổng quát hơn thuyết Arrhenius, phân tử không có nhóm OH như NH$_{3}$ hoặc ion như $CO_{3}^{2-}$ cùng là base
III. KHÁI NIỆM PH VÀ Ý NGHĨA
1. Khái niệm pH
pH = - lg[H$^{+}$] hoặc [H$^{+}$] = 10$^{-pH}$
Trong đó [H$^{+}$] là nồng độ mol của ion H$^{+}$
Nếu dung dịch có [H$^{+}$] = 10$^{-a}$ mol/L thì pH = a
CH$_{3}$COOH là chất điện li yếu ⟹ [H$^{+}$] < 0,1M ⟹ pH(CH$_{3}$COOH) > 1
pH(HCl) = 1 ; pH(NaCl) = 7 ; pH(NaOH) = 12
Vậy pH của dung dịch HCl nhỏ nhất.
2. Ý nghĩa của pH trong thực tiễn
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khỏe của con người, sự phát triển của động vật, thực vật,...
3. Xác định pH
Chất chỉ thị acid – base là chất có màu sắc biến đổi phụ thuộc vào giá trị pH của dung dịch
Màu của giấy quỳ, phenolphthalein và giấy pH trong dung dịch ở các khoảng pH khác nhau:
| Giấy quỳ | Đỏ pH ≤ 6 | Tím pH = 7 | Xanh pH ≥ 8 |
| Phenolphthalein | Không màu pH < 8 | Màu hồng pH > 8 | |
| Giấy pH | 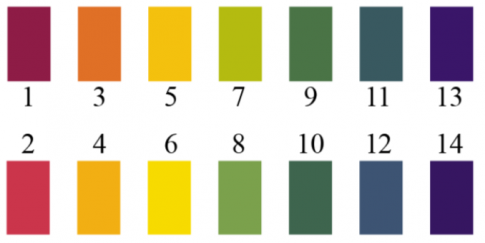 | ||
IV. SỰ THỦY PHÂN CỦA CÁC ION
pH của một số dung dịch:
AlCl$_{3}$ | NaCl | FeCl$_{3}$ | Na$_{2}$CO$_{3}$ | |
pH | < 7 | = 7 | < 7 | > 7 |
Giải thích về môi trường của các dung dịch
Xét dung dịch $Na_{2}CO_{3}$, ion Na$^{+}$ không phản ứng với nước, còn ion 4CO_{3}^{2-}$ thủy phân tạo môi trường base:
$CO_{3}^{2-}+H_{2}O\rightleftharpoons HCO_{3}^{-}+OH^{-}$
Vậy dung dịch $Na_{2}CO_{3}$ có môi trường base
Xét dung dịch AlCl$_{3}$ và FeCl$_{3}$, ion Cl$^{-}$ không phản ứng với nước, còn ion Al$^{3+}$ và Fe$^{3+}$ thủy phân tạo môi trường acid:
Al$^{3+}$ + H$_{2}$O ⇌ Al(OH)$^{2+}$ + H$^{+}$
Fe$^{3+}$ + H$_{2}$O ⇌ Fe(OH)$^{2+}$ + H$^{+}$
Vậy các dung dịch AlCl$_{3}$ và FeC$_{3}$ có môi trường acid
Xét dung dịch NaCl, NaCl khi tan trong nước phân li thành các ion:
NaCl ⟶ Na$^{+}$ + Cl$^{-}$
Vậy dung dịch NaCl có môi trường trung tính
Ứng dụng dung dịch muối $Na_{2}CO_{3}$, AlCl$_{3}$, FeCl$_{3}$:
$Na_{2}CO_{3}$ được sử dụng trong công nghiệp thực phẩm, dệt, nhuộm, công nghiệp thủy tinh, silicate,...
Phèn nhôm ((NH$_{4}$)$_{2}$SO$_{4}$.Al$_{2}$(SO$_{4}$)$_{3}$.24H$_{2}$O) và phèn sắt ((NH$_{4}$)$_{2}$SO$_{4}$.Fe$_{2}$(SO$_{4}$)$_{3}$.24H$_{2}$O) được sử dụng làm chất keo tụ trong quá trình xử lí nước
V. CHUẨN ĐỘ ACID – BASE
1. Nguyên tắc
Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
Nồng độ của dung dịch base mạnh (NaOH) được xác định bằng một dung dịch acid mạnh (HCl) đã biết trước nồng độ mol dựa trên phản ứng:
NaOH + HCl ⟶ NaCl + H$_{2}$O
Ta có: $V_{HCl}.C_{HCl} = V_{NaOH}.C_{NaOH}$
=> $C_{NaOH}=\frac{V_{HCl}.C_{HCl}}{V_{NaOH}}$
Trong đó:
- $C_{HCl}$ và $C_{NaOH}$ lần lượt là nồng độ mol của dung dịch HCl và NaOH
- $V_{HCl}$ và $V_{NaOH}$ lần lượt là thể tích của dung dịch HCl và dung dịch NaOH (cùng đơn vị đo)
Thời điểm để kết thúc chuẩn độ được xác định bằng sự đổi màu của chất chỉ thị phenolphthalein
2. Thực hành chuẩn độ acid – base
Tráng pipette và burette bằng chính dung dịch sẽ lấy
Đọc thể tích dung dịch: lưu ý khi đọc thể tích dung dịch trong pipette, burette cần để ngang tầm mắt, đọc chỉ số vạch thẳng với mặt cong chất lỏng
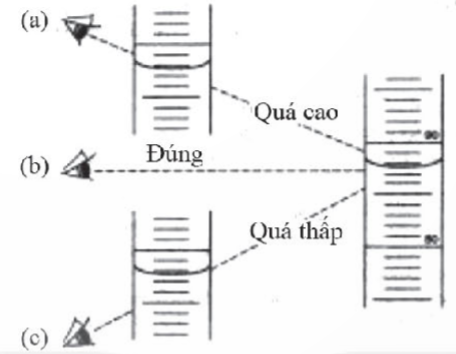
Lưu ý:
- Không để bọt khí ở cuống burette
- Khi cho dung dịch từ pipette vào bình tam giác: để pipette thẳng, nghiêng bình tam giác khoảng 45o, đầu pipette chạm vào thành bình, để dung dịch trong pipette chảy thành dòng
- Trong quá trình chuẩn độ, chú ý quan sát màu của dung dịch trong bình tam giác, khi dung dịch xuất hiện màu hồng nhạt bền trong 10 giây, lập tức dừng chuẩn độ
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận