Lý thuyết trọng tâm hóa học 11 cánh diều bài 17: Phenol
Tổng hợp kiến thức trọng tâm hóa học 11 cánh diều bài 17: Phenol. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. KHÁI NIỆM
1. Khái niệm
Phenol là những hợp chất hữu cơ trong phân tử có một hay nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene.
2. Phân loại
Những phenol trong phân tử một nhóm -OH thuộc nhóm monophenol.
Ví dụ:
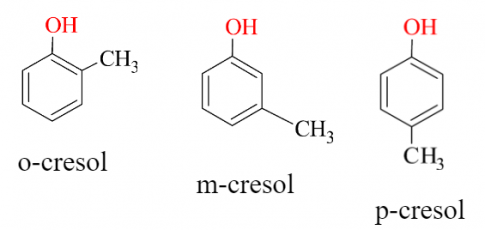
Những phenol trong phân tử chứa nhiều nhóm -OH thuộc nhóm polyphenol.
Ví dụ:
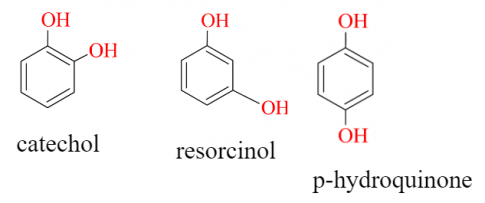
II. TÍNH CHẤT VẬT LÍ
- Ở điều kiện thường, phenol là chất rắn, không màu
- Phenol có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn các aryl halide có phân tử khối tương đương do phenol tạo ra liên kết hydrogen giữa các phân tử.
- Phenol ít tan trong nước ở điều kiện thường, tan nhiều khi đun nóng, tan tốt trong các dung môi hữu cơ.
III. TÍNH CHẤT HOÁ HỌC
1. Tính acid của phenol
Phenol thể hiện tính acid yếu. Dung dịch phenol không làm đổi màu quỳ tím.
a) Phản ứng với dung dịch NaOH
C6H5OH + NaOH → C6H5ONa + H2O
b) Phản ứng với dung dịch sodium carbonate
C6H5OH + Na2CO3 ⇌ C6H5ONa + NaHCO3
=> Như vậy, tính acid của phenol mạnh hơn so với alcohol.
Thí nghiệm 1. Phản ứng của phenol và dung dịch NaOH
Hiện tượng: Khi cho dung dịch NaOH vào ống nghiệm, lắc đều, dung dịch trở nên đồng nhất và trong suốt.
Giải thích: Phenol tan tốt trong dung dịch sodium hydroxide do có phản ứng:
C6H5OH + NaOH → C6H5ONa + H2O
Thí nghiệm 2. Phản ứng của phenol với dung dịch Na2CO3
Hiện tượng: Khi cho dung dịch Na2CO3 vào ống nghiệm, lắc đều, dung dịch trở nên đồng nhất và trong suốt.
Giải thích: Phenol tan trong dung dịch sodium carbonate:
C6H5OH + Na2CO3 ⇌ C6H5ONa + NaHCO3
2. Phản ứng thế nguyên tử H của vòng benzene
a) Phản ứng với nước bromine
Thí nghiệm 3. Phản ứng của phenol với nước bromine
Hiện tượng: Nước bromine mất màu và xuất hiện kết tủa trắng
Giải thích: Phenol phản ứng bromine, làm nước bromine mất màu, tạo kết tủa trắng 2,4,6-tribromophenol
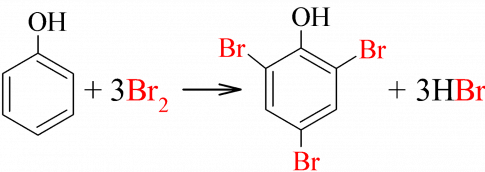
b) Phản ứng với dung dịch HNO3 đặc
Thí nghiệm 4. Phản ứng của phenol với nitric acid đặc
Giải thích: Phenol phản ứng với nitric acid tạo khói và dung dịch có màu đỏ tối. Sản phẩm thu được ở dạng kết tủa vàng là picric acid
PTHH:
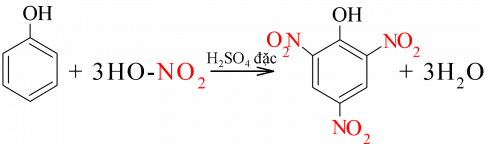
V. ỨNG DỤNG VÀ ĐIỀU CHẾ
1. Ứng dụng
Một số ứng dụng của phenol trong thực tiễn:
- Phenol là nguyên liệu chính để sản xuất bisphenol A, một chất trung gian dùng trong sản xuất nhựa epoxy. Phenol cũng được sử dụng nhiều trong sản xuất nhựa phenol – formaldehyde hay poly(phenol – formaldehyde).
- Phenol được dùng để sản xuất phẩm nhuộm, sản xuất thuốc nổ (2,4,6 – trinitrophenol), chất diệt cỏ 2,4 – D (2,4 – dichlorophenoxyacetic acid); chất diệt nấm mốc (các đồng phân của nitrophenol),…
- Do có tính diệt khuẩn nên phenol được dùng làm chất khử trùng, tẩy uế. Thuốc xịt chloraseptic chứa 1,4% phenol được dùng làm thuốc chữa đau họng.
2. Điều chế
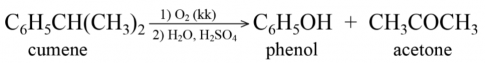
Trong công nghiệp, phenol được sản xuất từ cumene theo sơ đồ:
Phenol được tách ra từ nhựa than đá trong quá trình luyện cốc
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận