Đề thi giữa kì 1 Hóa học 10 CD: Đề tham khảo số 5
Trọn bộ Đề thi giữa kì 1 Hóa học 10 CD: Đề tham khảo số 5 bộ sách mới Cánh diều gồm nhiều câu hỏi ôn tập hay, các dạng bài tập phong phú giúp các em củng cố ôn luyện lại kiến thức thật tốt chuẩn bị tốt cho kì thi sắp tới. Tài liệu có kèm theo đáp án và lời giải chi tiết. Hi vọng đây sẽ là tài liệu hữu ích giúp các em đạt điểm cao. Thầy cô và các em kéo xuống để tham khảo ôn luyện
ĐỀ KIỂM TRA GIỮA HỌC KÌ 1
MÔN: HÓA HỌC 10 – KẾT NỐI TRI THỨC
I. PHẦN TRẮC NGHIỆM (28 câu × 0,25 = 7 điểm)
Câu 1: Hóa học có mấy nhánh chính?
A. Hai nhánh chính. B. Ba nhánh chính.
C. Bốn nhánh chính. D. Năm nhánh chính.
Câu 2: Chất nào sau đây thường được dùng để làm giảm cơn đau dạ dày?
A. NaCl. B. NaHCO3.
C. Na2O. D. CaCl2.
Câu 3: Đối tượng nghiên cứu của hóa học là
A. nghiên cứu về vật chất, năng lượng và sự vận động của chúng.
B. thế giới sinh vật gần gũi với đời sống hằng ngày của học sinh.
C. chất và sự biến đổi của chất.
D. nghệ thuật ngôn từ.
Câu 4: Hạt mang điện trong hạt nhân nguyên tử là
A. electron. B. proton.
C. neutron. D. neutron và electron.
Câu 5: Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
A. proton. B. neutron.
C. electron. D. neutron và electron.
Câu 6: Phát biểu nào sau đây không đúng?
A. Hạt nhân nguyên tử cấu thành từ các hạt proton và neutron.
B. Vỏ nguyên tử cấu thành từ các hạt electron.
C. Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron.
D. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
Câu 7: Hạt nhân của nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Tổng số hạt mang điện trong A là
A. 12. B. 24. C. 13. D. 6.
Câu 8: Khối lượng của nguyên tử magnesium là 39,8271.10-27 kg. Khối lượng của magnesium theo amu là
A. 23,978. B. 66,133.10-51.
C. 24,000. D. 23,985.
Câu 9: Nguyên tố hóa học là tập hợp những nguyên tử có cùng
A. số khối. B. số hạt neutron.
C. số hạt proton. D. số hạt neutron và số hạt proton.
Câu 10: Số proton và số neutron có trong một nguyên tử aluminium (![]() ) lần lượt là
) lần lượt là
A. 13 và 15. B. 12 và 14.
C. 13 và 13. D. 13 và 14.
Câu 11: Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có
A. cùng số proton nhưng khác nhau về số neutron.
B. cùng số neutron nhưng khác nhau về số proton.
C. cùng tổng số proton và neutron nhưng khác nhau về số electron.
D. cùng số electron nhưng khác nhau về tổng số proton và neutron.
Câu 12: Nguyên tố R có hai đồng vị, nguyên tử khối trung bình là 79,91. Một trong hai đồng vị là 79R (chiếm 54,5%). Nguyên tử khối của đồng vị thứ hai là
A. 80. B. 81. C. 82. D. 80,5.
Câu 13: Orbital nguyên tử là
A. đám mây chứa electron có dạng hình cầu.
B. đám mây chứa electron có dạng hình số tám nổi.
C. khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron trong khu vực đó là lớn nhất.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
Câu 14: Lớp L có số phân lớp electron là
A. 1. B. 2. C. 3 D. 4.
Câu 15: Cấu hình electron nguyên tử Al (Z = 13) là
A. 1s22s22p63s23p.. B. 1s22s22p63s1.
C. 1s22s22p63s23p1. D. 1s22s22p63s23p3.
Câu 16: Phát biểu nào đúng khi nói về các orbital trong một phân lớp electron?
A. Có cùng sự định hướng không gian.
B. Có cùng mức năng lượng.
C. Khác nhau về mức năng lượng.
D. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Câu 17: Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L. Số proton có trong nguyên tử X là
A. 7. B. 6. C. 8. D. 5.
Câu 18: Lớp M có các phân lớp là
A. 1s. B. 2s, 2p.
C. 3s, 3p, 3d. D. 4s, 4p, 4d, 4f.
Câu 19: Số lượng AO có trong lớp N là
A. 1. B. 4. C. 8. D. 16.
Câu 20: Electron chuyển động trong AO s được gọi là
A. electron d. B. electron s.
C. electron p. D. electron f.
Câu 21: Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p4. Số electron độc thân của M ở trạng thái cơ bản là
A. 3. B. 2. C. 1. D. 0.
Câu 22: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
A. kim loại và kim loại. B. phi kim và kim loại.
C. kim loại và khí hiếm. D. khí hiếm và kim loại.
Câu 23: Nguyên tử sulfur có phân lớp electron ngoài cùng là 3p4. Phát biểu nào sau đây là sai khi nói về nguyên tử sulfur?
A. Lớp ngoài cùng của sulfur có 6 electron.
B. Trong bảng tuần hoàn sulfur nằm ở chu kì 3.
C. Hạt nhân nguyên tử sulfur có 16 electron.
D. Sulfur nằm ở nhóm VIA.
Câu 24: Bảng tuần hoàn hiện nay không áp dụng nguyên tắc sắp xếp nào sau đây?
A. Mỗi nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn.
B. Các nguyên tố có cùng số lớp electron trên nguyên tử được xếp thành một hàng.
C. Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành một cột.
D. Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
Câu 25: Bảng tuần hoàn hiện nay có số chu kì là
A. 3. B. 5. C. 7. D. 9.
Câu 26: Chu kì 3 của bảng hệ thống tuần hoàn có số nguyên tố là
A. 2 nguyên tố. B. 8 nguyên tố.
C. 10 nguyên tố. D. 18 nguyên tố.
Câu 27: Số hiệu nguyên tử của nguyên tố Y là 19. Vị trí của Y trong bảng tuần hoàn là
A. số thứ tự 19, chu kì 3, nhóm VIIA. B. số thứ tự 19, chu kì 3, nhóm IA.
C. số thứ tự 19, chu kì 4, nhóm IIA. D. số thứ tự 19, chu kì 4, nhóm IA.
Câu 28: Nguyên tố chlorine (Z = 17) thuộc nhóm VIIA, có số electron hóa trị là
A. 1. B. 5. C. 7. D. 3.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Trong tự nhiên nguyên tố copper (kí hiệu: Cu) có 2 đồng vị là ![]() và
và ![]() , trong đó đồng vị
, trong đó đồng vị ![]() chiếm 27% về số nguyên tử. Tính phần trăm khối lượng của
chiếm 27% về số nguyên tử. Tính phần trăm khối lượng của ![]() trong phân tử Cu2O (biết rằng nguyên tử khối trung bình của O bằng 16).
trong phân tử Cu2O (biết rằng nguyên tử khối trung bình của O bằng 16).
Câu 2 (1 điểm): Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp s là 5. Số electron của X ít hơn số electron của Y là 4 hạt.
Xác định vị trí X, Y trong bảng tuần hoàn có giải thích ngắn gọn.
Câu 3 (1 điểm): Cho 2 kí hiệu nguyên tử sau: ![]() ,
, ![]() .
.
Biểu diễn cấu hình electron của A, B theo ô orbital, từ đó cho biết số electron độc thân của mỗi nguyên tử.
HƯỚNG DẪN GIẢI
ĐỀ THI GIỮA HỌC KÌ 1 - MÔN: HÓA HỌC 10
1-A | 2-B | 3-C | 4-B | 5-C | 6-D | 7-B |
8-D | 9-C | 10-D | 11-A | 12-B | 13-C | 14-B |
15-C | 16-B | 17-B | 18-C | 19-D | 20-B | 21-B |
22-B | 23-C | 24-D | 25-C | 26-B | 27-D | 28-C |
Câu 1:
Đáp án đúng là: A
Hóa học có năm nhánh chính, bao gồm: hóa lí thuyết và hóa lí; hóa vô cơ; hóa hữu cơ; hóa phân tích và hóa sinh.
Câu 2:
Đáp án đúng là: B
Người ta thường dùng thuốc muối (NaHCO3) để làm giảm cơn đau dạ dày.
Câu 3:
Đáp án đúng là: C
Đối tượng nghiên cứu của hóa học là chất và sự biến đổi của chất.
Câu 4:
Đáp án đúng là: B
Hạt mang điện trong hạt nhân nguyên tử là proton.
Câu 5:
Đáp án đúng là: C
Khối lượng electron (0,00055 amu) nhỏ hơn rất nhiều so với khối lượng của proton (1 amu) và neutron (1 amu).
Câu 6:
Đáp án đúng là: D
Phát biểu D không đúng vì nguyên tử có cấu trúc rỗng.
Câu 7:
Đáp án đúng là: B
A có số hạt proton = 24 – 12 = 12 (hạt).
Nguyên tử trung hòa về điện nên: số proton = số electron.
Tổng số hạt mang điện trong A bằng số proton + số electron = 24 (hạt).
Câu 8:
Đáp án đúng là: D
Ta có: 1 amu = 1,6605 × ![]() kg.
kg.
Khối lượng magnesium theo amu là:
![]() = 23,985 (amu).
= 23,985 (amu).
Câu 9:
Đáp án đúng là: C
Nguyên tố hóa học là tập hợp những nguyên tử có cùng số hạt proton.
Câu 10:
Đáp án đúng là: D
Dựa vào kí hiệu nguyên tử có:
+ Số proton = số hiệu nguyên tử (Z) = 13.
+ Số neutron = số khối (A) – số hiệu nguyên tử (Z) = 27 – 13 = 14.
Câu 11:
Đáp án đúng là: A
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số neutron.
Câu 12:
Đáp án đúng là: B
Một cách gần đúng, coi nguyên tử khối xấp xỉ số khối.
Gọi nguyên tử khối của đồng vị thứ 2 là R2. Ta có:
![]() 1 → R2 = 81.
1 → R2 = 81.
Câu 13:
Đáp án đúng là: C
Orbital nguyên tử (kí hiệu là AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
Câu 14:
Đáp án đúng là: B
Lớp L có 2 phân lớp là 2s và 2p.
Câu 15:
Đáp án đúng là: C
Cấu hình electron nguyên tử Al: 1s22s22p63s23p1.
Câu 16:
Đáp án đúng là: B
Các orbital trong một phân lớp electron có cùng mức năng lượng.
Câu 17:
Đáp án đúng là: B
Lớp L là lớp thứ 2.
Cấu hình electron nguyên tử X: 1s22s22p2.
X có số proton = số electron = 6.
Câu 18:
Đáp án đúng là: C
Lớp M (n = 3), có 3 phân lớp, được kí hiệu là 3s, 3p, 3d.
Câu 19:
Đáp án đúng là: D
Lớp N (n = 4) có số AO bằng n2 = 42 = 16.
Câu 20:
Đáp án đúng là: B
Electron chuyển động trong AO s được gọi là electron s.
Câu 21:
Đáp án đúng là: B
Cấu hình theo ô orbital của M như sau:
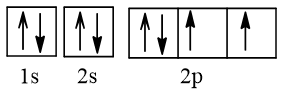
Vậy số electron độc thân của M ở trạng thái cơ bản là 2.
Câu 22:
Đáp án đúng là: B
Ta có:
Cấu hình electron nguyên tử X: 1s22s22p63s23p5 → X có 5 electron lớp ngoài cùng ⇒ X là phi kim.
Cấu hình electron nguyên tử Y: 1s22s22p63s23p64s1 → Y
có 1 electron lớp ngoài cùng ⇒ Y là kim loại.
Câu 23:
Đáp án đúng là: C
Trong hạt nhân nguyên tử không có chứa electron.
Câu 24:
Đáp án đúng là: D
Ngày nay, các nguyên tố hóa học được sắp xếp từ trái sang phải và từ trên xuống dưới theo chiều tăng dần điện tích hạt nhân của nguyên tử.
Câu 25:
Đáp án đúng là: C
Bảng tuần hoàn hiện nay gồm 7 chu kì.
Câu 26:
Đáp án đúng là: B
Chu kì 3 của bảng tuần hoàn có 8 nguyên tố.
Câu 27:
Đáp án đúng là: D
Cấu hình electron nguyên tử Y: [Ar]4s1.
Vậy Y thuộc ô thứ 19 (do số hiệu nguyên tử là 19), chu kì 4 (do có 4 lớp electron), nhóm IA (do 1 electron hóa trị, nguyên tố s).
Câu 28:
Đáp án đúng là: C
Đối với các nguyên tố nhóm A, số electron hóa trị cũng chính là số electron ở lớp ngoài cùng.
Nguyên tố chlorine ở nhóm VIIA, có số electron hóa trị là 7.
Phần: Tự luận
Câu 1:
Nguyên tử khối trung bình của copper là:
![]() = 63,54.
= 63,54.
Phân tử khối của Cu2O là: 2.63,54 + 16 = 143,08.
Phần trăm khối lượng của 2.63,54 + 16 = 143,08 trong phân tử Cu2O là
![]() . 100% = 64,29%
. 100% = 64,29%
Câu 2:
+ Cấu hình electron nguyên tử X: 1s22s22p63s1.
Vậy X ở ô thứ 11 (do số hiệu nguyên tử = số electron = 11); chu kì 3 (do có 3 lớp electron); nhóm IA (do 1 electron hóa trị, nguyên tố s).
+ Y nhiều hơn X 4 hạt electron, cấu hình electron nguyên tử Y là: 1s22s22p63s23p3.
Vậy Y ở ô thứ 15 (do số hiệu nguyên tử = số electron = 15); chu kì 3 (do có 3 lớp electron); nhóm VA (do 5 electron hóa trị, nguyên tố p).
Câu 3:
+ Dựa vào kí hiệu nguyên tử có ZA = 9.
Cấu hình electron nguyên tử A: 1s22s22p5.
Biểu diễn cấu hình electron nguyên tử A theo ô orbital:
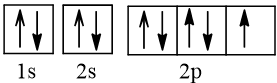
Vậy ở trạng thái cơ bản, A có 1 electron độc thân.
+ Dựa vào kí hiệu nguyên tử có ZB = 14.
Cấu hình electron nguyên tử B: 1s22s22p63s2.
Biểu diễn cấu hình electron nguyên tử B theo ô orbital:
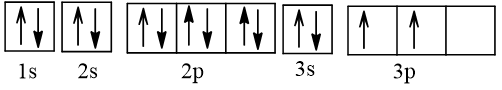
Vậy ở trạng thái cơ bản, B có 2 electron độc thân.
Thêm kiến thức môn học
Đề thi Hóa học 10 Cánh diều, trọn bộ đề thi Hóa học 10 Cánh diều, Đề thi giữa kì 1 Hóa học 10

Bình luận