Slide bài giảng Vật lí 12 Cánh diều bài 2: Phương trình trạng thái khí lí tưởng
Slide điện tử bài 2: Phương trình trạng thái khí lí tưởng. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của môn Vật lí 12 Cánh diều sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
BÀI 2. PHƯƠNG TRÌNH TRẠNG THÁI KHÍ LÍ TƯỞNG
MỞ ĐẦU
 Câu hỏi: Bình chứa oxygen (Hình 2.1) là một thiết bị thường dùng trong điều trị người bệnh có vấn đề về hô hấp. Tuy nhiên, khi sử dụng bình cần đặc biệt chú ý nơi bảo quản nhằm đảm bảo an toàn do nguy cơ cháy nổ cao.
Câu hỏi: Bình chứa oxygen (Hình 2.1) là một thiết bị thường dùng trong điều trị người bệnh có vấn đề về hô hấp. Tuy nhiên, khi sử dụng bình cần đặc biệt chú ý nơi bảo quản nhằm đảm bảo an toàn do nguy cơ cháy nổ cao.
Khí oxygen trong bình ở áp suất cao nên không phải là khí lý tưởng. Tuy nhiên, người ta vẫn sử dụng mô hình khí lí tưởng để tìm hiểu mối liên hệ giữa các thông số của một lượng khí như áp suất, nhiệt độ và thể tích, từ đó suy ra nguyên tắc bảo quản và sử dụng an toàn các bình chứa khí.
Vậy mối liên hệ đó như thế nào?
Trả lời rút gọn:
Mối liên hệ giữa các thông số áp suất, nhiệt độ, thể tích dựa trên phương trình trạng thái của khí lí tưởng.
I. MỐI LIÊN HỆ GIỮA THỂ TÍCH VÀ ÁP SUẤT CỦA CHẤT KHÍ
Câu 1: Lập phương án thí nghiệm tìm mối liên hệ giữa thể tích khí và áp suất của nó khi giữ nhiệt độ không đổi với các dụng cụ thực hành ở trường của bạn.
Trả lời rút gọn:
Dụng cụ
– Áp kế (1)
– Xilanh (2).
– Pit-tông (3) gắn với tay quay (4).
Phương án thí nghiệm
- Mở van áp kế, dùng tay quay dịch chuyển pit-tông sang phải để lấy một lượng khí xác định vào xilanh.
- Đóng van, đọc và ghi giá trị áp suất p (hiện trên áp kế), thể tích V của khí trong xilanh (theo vạch chia trên xilanh) khi đó.
- Dùng tay quay cho pit-tông dịch chuyển từ từ đến các vị trí mới. Đọc giá trị, tương ứng với mỗi vị trí và ghi kết quả.
- Vẽ đồ thị biểu diễn mối liên hệ giữa thể tích và áp suất của chất khí khi nhiệt độ không đổi.
- Tính tích pV của mỗi lần đo và rút ra nhận xét.
Câu 2: Việc dịch chuyển pit-tông từ từ giúp đảm bảo điều kiện gì?
Trả lời rút gọn:
Việc dịch chuyển pit-tông từ từ nhằm đảm bảo điều kiện nhiệt độ không thay đổi.
Câu 3: Vẽ đồ thị p - V theo số liệu thu được trong thí nghiệm đã thực hiện hoặc theo số liệu ở Bảng 2.1 và so sánh với dạng đồ thị trong Hình 2.4.

Trả lời rút gọn:
Lần đo | Áp suất khí trong xilanh p (Bar) | Thể tích khí trong xilanh V (ml) | pV |
(1) | 1,14 | 130 | 148,2 |
(2) | 1,18 | 125 | 147,5 |
(3) | 1,23 | 120 | 147,6 |
(4) | 1,28 | 115 | 147,2 |
(5) | 1,35 | 110 | 148,5 |
Đồ thị:
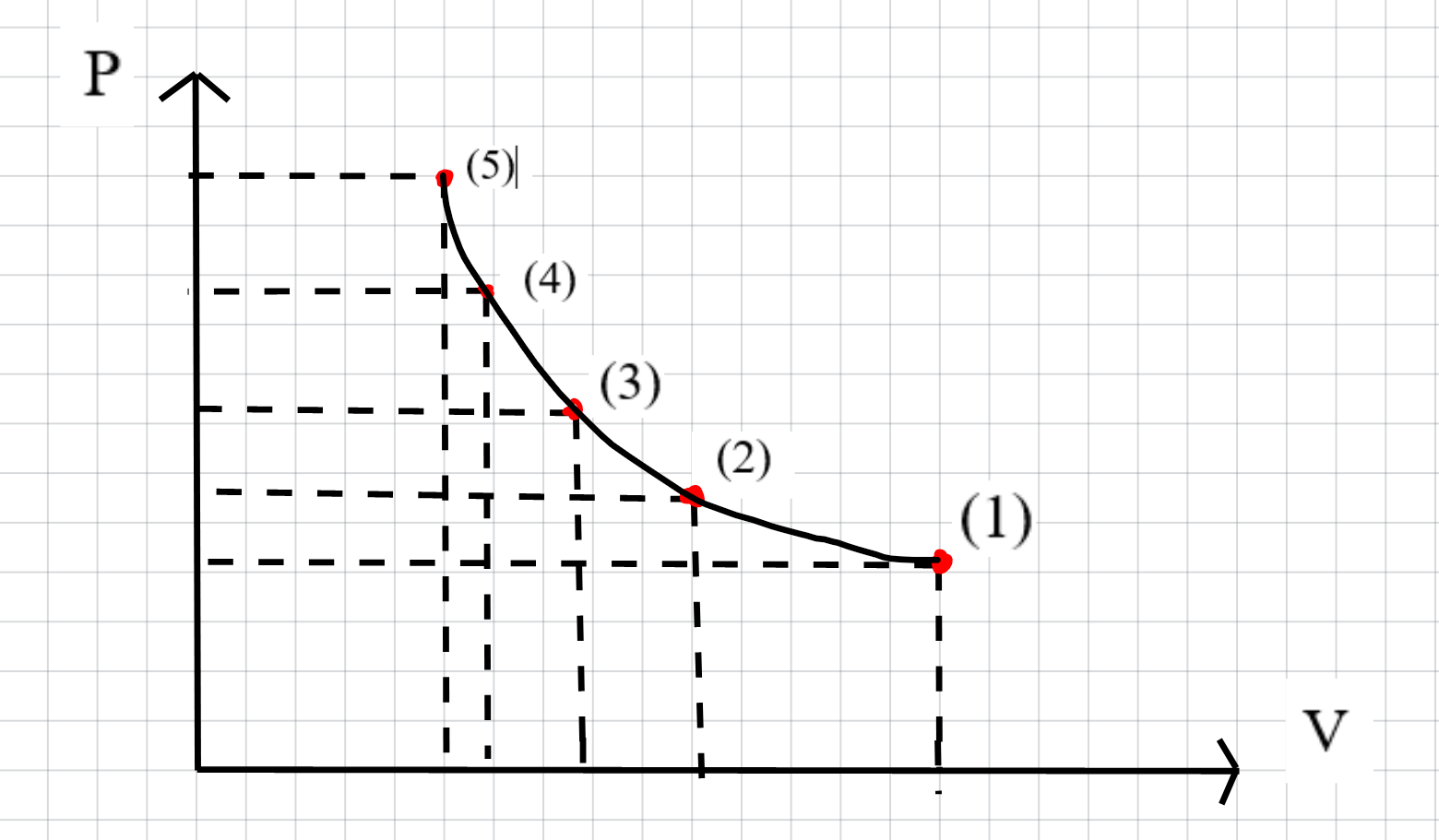
Đồ thị thu được có dạng giống hình 2.4 và là một hypebol.
Câu 4: Đồ thị p theo 1/V có dạng đường thẳng mà nếu kéo dài sẽ đi qua gốc toạ độ cho thấy giữa hai đại lượng p và V có mối quan hệ gì?
Trả lời rút gọn:
Hai đại lượng p và V có mối quan hệ tỉ lệ nghịch.
Khi thể tích khí V ở vô cùng (1/V tiến về 0), áp suất khí p tiến về 0.
Luyện tập 1: Một quả bóng có chứa 0,04 m³ khí ở áp suất 120 kPa. Nếu giảm thể tích quả bóng xuống còn 0,025 m³ ở nhiệt độ không đổi thì áp suất khí trong bóng là bao nhiêu?
Trả lời rút gọn:
Áp dụng định luật Boyle:
P1⋅V1 = P2⋅V2
=> P2 = P1.V1/V2 = 120.0,04/0,025 = 192 kPa
II. MỐI LIÊN HỆ GIỮA THỂ TÍCH VÀ NHIỆT ĐỘ CỦA CHẤT KHÍ
Câu 5: Sử dụng các kí hiệu T₁, V₁, T2, và V₂ để viết công thức định luật Charles cho một quá trình đẳng áp của lượng khí xác định.
Trả lời rút gọn:
Định luật Charles:
![]()
Luyện tập 2: Một xilanh chứa 0,16 dm³ khí nitrogen ở nhiệt độ phòng 25°C và áp suất 1,2 atm (1 atm = 1,01 105 Pa). Hơ nóng xilanh từ từ sao cho áp suất khí trong xilanh không đổi thì khi thể tích khí trong xilanh là 0,20 dm³, nhiệt độ của khí trong xilanh là bao nhiêu?
Trả lời rút gọn:
![]()
Vậy nhiệt độ của khí trong xilanh khi thể tích là 0,20 dm³ là 372,5 K.
Câu 6: Xây dựng phương án thí nghiệm minh hoạ mối liên hệ giữa nhiệt độ và thể tích của một lượng khí xác định khi giữ áp suất của khí không đổi bằng các dụng cụ ở trường của bạn.
Trả lời rút gọn:
Dụng cụ
– Áp kế (1)
- Xilanh (2)
– Pit-tông (3) gắn với tay quay (4).
– Hộp chứa nước nóng (5)
– Cảm biến nhiệt độ (6)
Phương án thí nghiệm
– Đọc giá trị phần thể tích chứa khí của xilanh ban đầu.
– Đọc số chỉ của cảm biến nhiệt độ đo nhiệt độ phòng cũng là nhiệt độ khí trong xilanh lúc đầu.
- Đổ nước nóng vào hộp chứa cho ngập hoàn toàn xilanh. Dịch pit-tông từ từ sao cho số chỉ của áp kế không đổi. Đọc giá trị của phần thể tích chứa khí và nhiệt độ sau mỗi phút.
- Ghi kết quả.
- Tính tỉ số V/T của mỗi lần đo và rút ra nhận xét.
- Vẽ đồ thị biểu diễn mối liên hệ giữa nhiệt độ và thể tích chất khí khi áp suất không đổi.
Câu 7: So sánh đồ thị nhiệt độ – thể tích thu được theo kết quả thí nghiệm đã thực hiện với đồ thị trong Hình 2.5.
Trả lời rút gọn:
Lần đo | Nhiệt độ của khí trong xilanh (oC) | Thể tích khí trong xilanh (ml) | V/T |
1 | 45 | 75 | 0,236 |
2 | 41 | 74 | 0,236 |
3 | 37 | 73 | 0,2355 |
4 | 32 | 72 | 0,236 |
5 | 28 | 71 | 0,236 |
Đồ thị thu được ở bảng số liệu trên có dạng giống với đồ thị của hình 2.5.
III. PHƯƠNG TRÌNH TRẠNG THÁI KHÍ LÍ TƯỞNG
Câu 8: Với quá trình biến đổi được biểu diễn trên Hình 2.9, hãy so sánh nhiệt độ, thể tích, áp suất của trạng thái 1 với trạng thái 2, của trạng thái 2' với trạng thái 2.
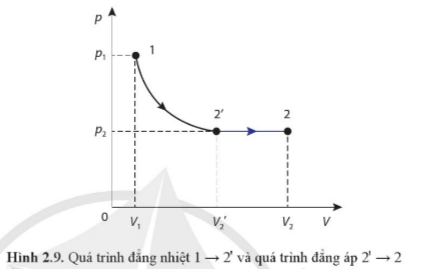
Trả lời rút gọn:
T1=T2’<T2
P1>P2’=P2
V2>V2’>V1.
Câu 9: Hãy giả sử chất khí biến đổi từ trạng thái 1 sang trạng thái 2 qua trạng thái trung gian 3 (khác với 2') và lập luận để vẫn thu được công thức (2.6)
Trả lời rút gọn:
1->3 là quá trình đẳng áp nên P1=P3 và V1/T1= V3/T3
Do đó P1.V1/T1=P3.V3/T3 (1)
3->2 là quá trình đẳng nhiệt nên T3=T2 và P2.V2=P3.V3
Do đó P3V3/T3=P2.V2/T2 (2)
Từ (1) và (2) ta có:
P1.V1/T1 = P2.V2/T2 = P3.V3/T3
Vậy từ trạng thái (1) đến trạng thái 2 bất kì ta luôn có P.V/T = const (đpcm).
Luyện tập 3: Một lốp xe chứa 0,020 m³ không khí ở 27 °C và áp suất 3,0. 105 Pa. Tính khối lượng không khí trong lốp xe. Biết khối lượng mol của không khí là 28,8 g/mol.
Trả lời rút gọn:
Phương trình trạng thái của khí lí tưởng: PV=nRT
=> n = PV/RT ≈ 2,41mol
Khối lượng của không khí trong lốp xe là
m = n.M = 2,41.28,8 = 69,4g.
Vận dụng: Hãy vận dụng định luật Boyle để giải thích nguyên lí hoạt động của loại bình xịt như trong hình 2.10.

Trả lời rút gọn:
Nguyên lí hoạt động của loại bình xịt: Khi nút xịt của bình xịt cồn được nhấn, áp suất trong bình tăng lên đột ngột do áp lực tác dụng. Theo định luật Boyle-Mariotte, khi áp suất tăng, thể tích của không khí bên trong bình giảm. Điều này làm tăng nồng độ cồn trong không gian bình, tạo ra dòng cồn bắn ra từ nút xịt. Dòng cồn này kết hợp với không khí, tạo thành một dòng hơi cồn khử khuẩn được phân tán vào không gian xung quanh.
