Vì sao phải sử dụng cốc chia độ?
2. Thí nghiệm về năng lượng hóa học qua phản ứng của magnesium tác dụng với dung dịch hydrochloric acid
Câu hỏi 6: Vì sao phải sử dụng cốc chia độ?
Câu hỏi 7: Vì sao HCl được cho vào rất dư so với lượng cần phản ứng?
Câu hỏi 8: Vì sao nhiệt độ lại tăng lên khi phản ứng xảy ra?
Câu hỏi 9: Vì sao nhiệt độ hỗn hợp chỉ tăng lên tới 46oC?
Câu hỏi 10: Vì sao sau đó nhiệt độ dung dịch lại giảm dần?
Câu hỏi 11: Một bạn học sinh tính lượng nhiệt tỏa ra trong thí nghiệm như sau. Biết rằng, nhiệt dung riêng của nước là 4,184 J g-1 K-1 (nghĩa là để nâng nhiệt độ của 1,0 g nước lên 1oC thì cần cung cấp 4,184 J nhiệt lượng); khối lượng riêng của nước, D = 1 g mL-1.
Một bạn học sinh tính lượng nhiệt tỏa ra trong thí nghiệm như sau. Biết rằng, nhiệt dung riêng của nước là 4,184 J g-1 K-1 (nghĩa là để nâng nhiệt độ của 1,0 g nước lên 1oC thì cần cung cấp 4,184 J nhiệt lượng); khối lượng riêng của nước, D = 1 g mL-1.
- Khối lượng nước là m = V × D = 50 × 1,0 = 50 g
- Lượng nhiệt tỏa ra tính được theo công thức:
Q = C × m × (T2 – T1) = 4,184 × 50 × (46 – 25) = 4393,2 J
Lượng nhiệt tỏa ra thực tế trong thí nghiệm này là bao nhiêu kJ? Vì sao lại có sự sai khác giữa kết quả tính của bạn học sinh và kết quả thực tế?
Câu hỏi 12: Cho biết $\Delta _{f}H_{298}^{o}$ (kJ mol-1) các chất ở trạng thái tương ứng như sau:
Chất | Mg(s) | H2(g) | HCl(g) | HCl(aq) | MgCl2(s) | MgCl2(aq) |
$\Delta _{f}H_{298}^{o}$ | 0 | 0 | -92,3 | -167,16 | -641,1 | -800 |
Hãy viết phương trình hóa học của phản ứng diễn ra trong thí nghiệm trên và tính $\Delta _{f}H_{298}^{o}$ của phản ứng.
Thực hành 1: Thực hành về tính chất phân cực của phân tử qua bài thí nghiệm Cực tính của phân tử, phần mềm PhET.
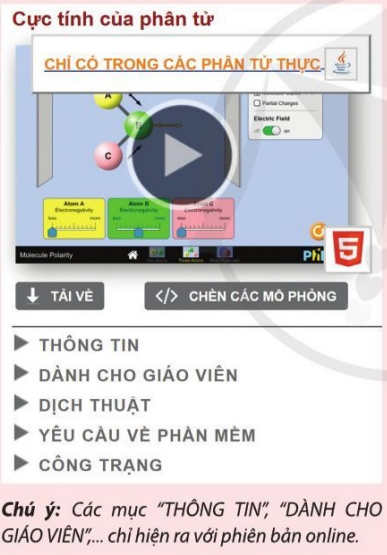
Thực hành để làm rõ được những vấn đề nêu ra trong mục “THÔNG TIN” như sau:
Mô tả
Khi nào thì phân tử phân cực? Thay đổi độ âm điện của nguyên tử trong một phân tử để thấy ảnh hưởng của nó lên sự phân cực. Quan sát phản ứng của một phân tử đặt trong điện trường. Thay đổi góc liên kết để thấy ảnh hưởng của hình dạng lên sự phân cực.
Mục tiêu học tập
- Quan sát được sự thay đổi cực tính của phân cực khi thay đổi độ âm điện các nguyên tử.
- Hiển thị cực tính bằng mũi tên hay điện tích riêng phần.
- Sắp xếp các liên kết theo thứ tự độ phân cực.
- Tiên đoán cực tính của phân tử bằng cách thay đổi độ phân cực của liên kết và hình dạng phân tử.
Thực hành 2: Thực hành về tính chất của các nguyên tố halogen qua mục “Halogens” của phần mềm Yenka. Thực hiện theo các chỉ dẫn của phần mềm và trả lời câu hỏi phần mềm đưa ra.
Thực hành 3: (Làm việc nhóm) Tìm hiểu bài thí nghiệm hóa học ảo trong phần mềm Yenka và ứng dụng PhET có liên quan đến các chủ đề và chuyên đề trong Chương trình Hóa học 10 (mỗi chủ đề, chuyên đề ít nhất một thí nghiệm). Tiến hành thí nghiệm, quan sát để liên hệ với các nội dung lí thuyết đã học
Câu hỏi 6: Sử dụng cốc chia độ để lấy được chính xác lượng dung dịch hydrochloric acid 2M (là 50 mL).
Câu hỏi 7: HCl được cho vào rất dư so với lượng cần phản ứng để Mg phản ứng hoàn toàn.
Câu hỏi 8: Nhiệt độ tăng lên khi phản ứng xảy ra do phản ứng tỏa nhiệt (có biến thiên enthalpy của phản ứng là -466,0 kJ < 0).
Câu hỏi 9: 1 mol Mg phản ứng tỏa ra 466,0 kJ nhiệt lượng
0,24 gam = 0,01 mol Mg tỏa ra 466.0,01 = 4,66kJ nhiệt lượng.
Lượng nhiệt này tương đương với 46oC.
Câu hỏi 10: Phản ứng kết thúc, đồng thời dừng tỏa nhiệt. Sau khi phản ứng kết thúc, nhiệt độ trong cốc giảm dần để cân bằng với nhiệt độ môi trường.
Câu hỏi 11: Lượng nhiệt tỏa ra thực tế trong thí nghiệm này là 4,66 kJ.
Có sự sai khác giữa kết quả tính của bạn học sinh và kết quả thực tế là do ảnh hưởng của nhiệt độ môi trường.
Câu hỏi 12: Phương trình hóa học của phản ứng:
Mg(s) + 2HCl((aq) → MgCl2(aq) + H2(g)
$\Delta _{r}H_{298}^{o}$ = $\Delta _{f}H_{298}^{o}$(MgCl2(aq)) + $\Delta _{f}H_{298}^{o}$(H2(g)) - $\Delta _{f}H_{298}^{o}$(Mg(s)) – 2. $\Delta _{f}H_{298}^{o}$(HCl((aq))
$\Delta _{r}H_{298}^{o}$ = (-800) + 0 – 0 – 2.(-167,16) = -465,68 kJ.
Thực hành 1
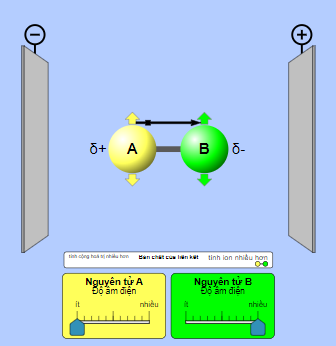
- Phân tử phân cực khi có sự chênh lệch độ âm điện giữa các nguyên tử liên kết. Chênh lệch độ âm điện càng lớn thì phân tử phân cực càng mạnh.
- Phân tử bị lệch trong điện trường, cụ thể phần mang điện tích âm bị lệch về phía cực dương, phần mang điện tích dương bị lệch về phía cực âm.
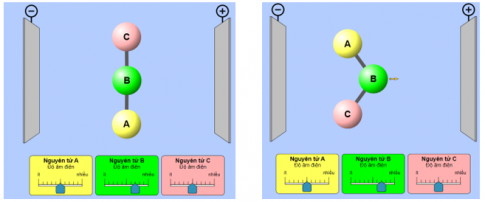
- Dự đoán: Hình dạng phân tử có làm ảnh hưởng đến sự phân cực.
Thực hành 2
Thực hiện các chỉ dẫn của phần mềm và trả lời câu hỏi phần mềm đưa ra như sau:
1. In this kit you will learn how some of the properties of the halogens (the elements in Group 7 of the Periodic Table) vary.
(Trong thí nghiệm này, em sẽ được học về một số thuộc tính khác nhau của halogens (các nguyên tố nhóm VII trong bảng tuần hoàn).
2. Chlorine gas is in the leftt – hand flask and iodine solid is in the right – hand flask
(Khí chlorine ở bình phía bên tay trái và chất rắn iodine ở bình phía tay phải).
3. Chlorine is a green – yellow gas at room temperature, while iodine is a black solid. What does this tell you about their boiling points?
A. The boiling point of chlorine is lowest.
B. The boiling point of chlorine is highest.
C. The boiling point are the same.
(Chlorine là chất khí có màu vàng xanh ở nhiệt độ phòng, trong khi iodine là một chất rắn màu đen. Điều này cho em biết điều gì về nhiệt độ sôi của chúng?
A. Nhiệt độ sôi của chlorine thấp nhất
B. Nhiệt độ sôi của chlorine cao nhất.
C. Nhiệt độ sôi như nhau.
Trả lời: Đáp án A (Nhiệt độ sôi của chlorine thấp hơn nhiệt độ sôi của iodine.)
4. Heat the iodine gently, by dragging the slider on the heater slowly upwards, until it turns into a gas. At what temperature does this happen?
(Làm nóng iodine nhẹ nhàng, bằng cách kéo chậm thanh trượt trên lò sưởi hướng lên trên cho đến khi nó chuyển thành khí. Điều này xảy ra ở nhiệt độ nào?
Trả lời: Kéo thanh trượt (hoặc có thể thay đổi nhiệt độ bằng cách nhấn chuột vào nhiệt độ khi trên bếp và nhập số) iodine chuyển thành khí ở 187oC.
5. Turn the heat on both heaters to 200oC
(Vặn nhiệt trên cả hai bếp thành 200oC)
6. Drag on the metals and add them to both flasks. Observe which metals react. Which is the more reactive gas?
A. Chlorine
B. Iodine
(Kéo kim loại và thêm chúng vào cả hai bình. Quan sát kim loại nào phản ứng. Chất khí nào phản ứng mạnh hơn?)
Trả lời: Đáp án A (Chlorine phản ứng mạnh hơn với các kim loại.)
Thực hành 3
Ví dụ: Sử dụng thể Open – local để mô phỏng thí nghiệm về ảnh hưởng của nồng độ acid HCl đến tốc độ phản ứng:
2HCl(aq) + CaCO3(s) → CaCl2(aq) + CO2(g) + H2O(l) (1)
Cách tiến hành:
Bước 1: Nháy chuột vào thẻ Open – local, chọn Reaction Rates.
Bước 2: Nháy chuột vào Concentration and rate (ảnh hưởng của nồng độ lên tốc độ phản ứng). Một mô phỏng đã được thiết kế xuất hiện ở màn hình.

Bước 3: Nháy chuột vào các quả bóng có màu khác nhau, kéo thả vào cuối ống dẫn khí ở các ống nghiệm có nồng độ khác nhau.
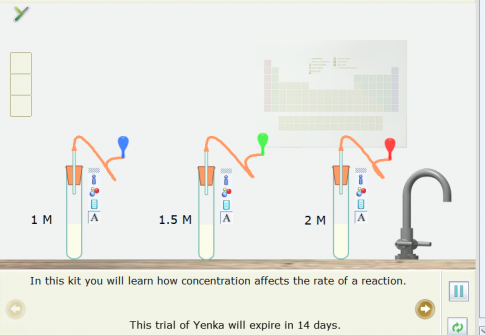
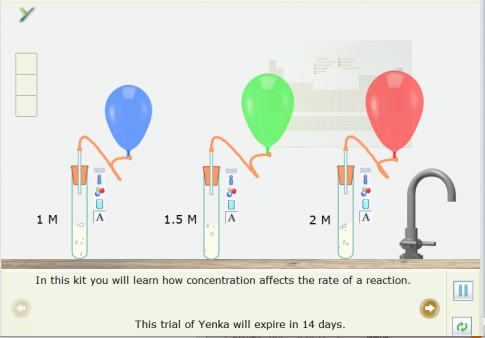
Bước 4. Nháy chuột vào nút Pause để thực hiện mô phỏng. Sau khoảng 9 giây nháy chuột lại vào nút Pause để dừng mô phỏng.



Bình luận