Sử dụng phương pháp PM7 để xác định đồng phân cis-2-butene hay trans-2-butene
Bài tập
Bài 1:Sử dụng phương pháp PM7 để xác định đồng phân cis-2-butene hay trans-2-butene bền hơn. Biết rằng, đồng phân có năng lượng tổng âm hơn sẽ bền hơn:
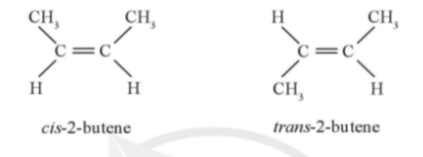
Bài 2: Sử dụng phương pháp PM7 tính cấu trúc (độ dài liên kết, góc liên kết), nhiệt tạo thành, năng lượng tổng của 3 đồng phân o, m, p-cresol. So sánh độ bền giữa các đồng phân.
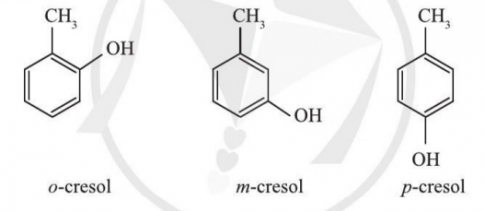
Bài 3: Cho dãy hợp chất H2X, với X là các nguyên tố nhóm VIA gồm O, S, Se. Sử dụng phương pháp tính PM7 để tối ưu hóa cấu trúc, từ đó tính độ dài liên kết X-H và góc HXH. Tìm quy luật biến đổi các giá trị này trong dãy nêu trên.
Bài 4: Sử dụng phương pháp PM7 để tối ưu hóa cấu trúc, từ đó tính (độ dài liên kết, góc liên kết) các chất có trong các phương trình phản ứng sau:
O2(g) + 2H2(g) → 2H2O(g) (1)
F2(g) + H2(g) → 2HF (g) (2)
a) Tính biến thiên enthalpy của phản ứng (1) và (2) theo phương pháp PM7. So sánh kết quả nhận được với kết quả tính từ enthalpy tạo thành chuẩn của các chất trong Phụ lục 2.
b*) Tính biến thiên năng lượng của phản ứng (1) và (2). Từ đó, so sánh khả năng phản ứng của oxygen và fluorine với hydrogen.
Biết rằng, biến thiên năng lượng của phản ứng cũng được tính giống như biến thiên enthalpy của phản ứng, nhưng thay nhiệt tạo thành bởi năng lượng tổng của phân tử.
Chú ý: Enthalpy tạo thành chuẩn của các đơn chất ở trạng thái bền bằng 0.
Bài 5: Bằng cách tối ưu hóa cấu trúc, hãy xác định độ dài các liên kết H–X (với X là F, Cl, Br, I).
Bài 1:
Đồng phân cis-2-butene có năng lượng tổng là -599,1911 EV
(Phần kết quả: ![]() )
)
Đồng phân trans-2-butene có năng lượng tổng là -599,2290 EV
(Phần kết quả: ![]() )
)
⇒ trans-2-butene bền hơn do có năng lượng tổng âm hơn.
Bài 2:
Sử dụng phương pháp PM7 ta có bảng sau:
Đồng phân | o-cresol | m-cresol | p-cresol | |
Nhiệt tạo thành (kJ/mol) | -129,08980 | -134,94981 | -130,75217 | |
Năng lượng tổng (EV) | -1263,1321 | -1263,1939 | -1263,1509 | |
Độ dài liên kết ($\overset{o}{A}$) | d(C-O) | 1,36 | 1,359 | 1,36 |
d(O-H) | 0,987 | 0,987 | 0,987 | |
d(C-CH3) | 1,489 | 1,491 | 1,491 | |
Góc liên kết (o) | $\widehat{COH}$ | 112,336o | 112,251o | 112,141o |
Đồng phân có năng lượng tổng âm hơn sẽ bền hơn. Dựa vào kết quả ta thấy độ bền của các đồng phân được sắp xếp như sau: o-cresol < p-cresol < m-cresol.
Bài 3:
Với hợp chất H2O:
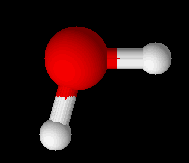
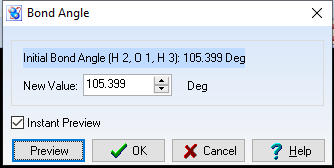
d(O-H) = 0,956$\overset{o}{A}$

Góc $\widehat{HOH}= 105,399^{o}$
Với hợp chất H2S:
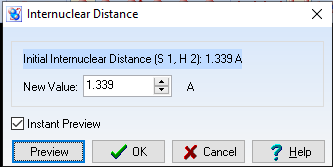
d(S-H) = 1,339$\overset{o}{A}$
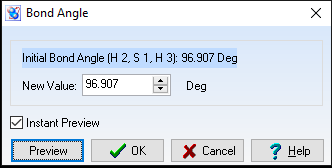
Góc $\widehat{HSH}= 96,907^{o}$
Với hợp chất H2Se:
d(Se-H) = 1,465$\overset{o}{A}$
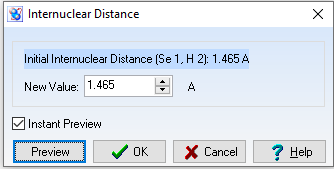
Góc $\widehat{HSeH}= 93,752^{o}$

Nhận xét:
Trong nhóm VIA từ O đến Se độ dài liên kết X-H tăng dần; góc liên kết HXH giảm dần.
Bài 4: a) Tính biến thiên enthalpy của phản ứng (1) và (2) theo phương pháp PM7:
$\Delta _{f}H_{298}^{o}$(H2O) = -241,83333 kJ/mol
$\Delta _{f}H_{298}^{o}$ (HF) = -259,13839 kJ/mol
$\Delta _{r}H_{298}^{o}$(1) = 2. $\Delta _{f}H_{298}^{o}$(H2O) – 1.0 – 2.0 = 2.(-241,83333) = -483,66666 kJ
$\Delta _{r}H_{298}^{o}$ (2)= 2. (HF) – 1.0 – 1.0 = 2.(-259,13839) = -518,27678 kJ
Tính biến thiên enthalpy của phản ứng (1) và (2) theo enthalpy tạo thành ở phụ lục 2:
$\Delta _{f}H_{298}^{o}$(H2O) = -241,8 kJ.mol-1
$\Delta _{f}H_{298}^{o}$ (HF) = -273,3 kJ.mol-1
$\Delta _{r}H_{298}^{o}$(1) = 2. (H2O) – 1.0 – 2.0 = 2.(-241,8) = -483,6 kJ
$\Delta _{r}H_{298}^{o}$(2) = 2. (HF) – 1.0 – 1.0 = 2.(-273,3) = -546,6 kJ
So sánh: Kết quả nhận được với kết quả tính từ enthalpy tạo thành chuẩn của các chất trong Phụ lục 2 là xấp xỉ nhau.
b*) Biến thiên năng lượng của phản ứng (1)
$\Delta _{r}H_{298}^{o}$= 2.năng lượng tổng H2O – (năng lượng tổng O2 + 2.năng lượng tổng H2)
= 2. (-322,6792) – [-585,9147 + 2.( -28,0470)] = -3,3497 eV
Biến thiên năng lượng của phản ứng (2)
$\Delta _{r}H_{298}^{o}$ = 2.năng lượng tổng HF – (năng lượng tổng F2 + năng lượng tổng H2)
= 2.(-479,5304) – [-927,7183 + (-28,0470)] = -3,2955 eV
Nhận xét:
Phản ứng giữa hydrogen và fluorine xảy ra thuận lợi hơn.
Bài 5:
Bằng cánh tối ưu hoá cấu trúc, độ dài các liên kết lân lượt bằng
d(H–F) = 0,896 $\overset{o}{A}$
d(H–Cl) = 1,273 $\overset{o}{A}$
d(H–Br) = 1,459 $\overset{o}{A}$
d(H–I) = 1,637 $\overset{o}{A}$

Bình luận