Lý thuyết trọng tâm hóa học 11 cánh diều bài 5: Một số hợp chất quan trọng của Nitrogen
Tổng hợp lý thuyết trọng tâm hóa học 11 cánh diều bài 1: Mở đầu về cân bằng hóa học. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
[toc:ul]
I. AMMONIA
1. Cấu tạo phân tử và tính chất vật lí
Công thức Lewis và dạng hình học (hình chóp tam giác) của phân tử NH$_{3}$ được thể hiện ở Hình 5.1.
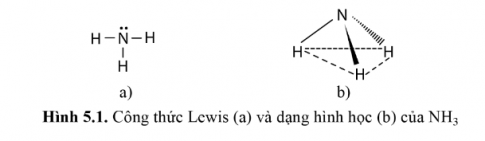
Các liên kết N – H là liên kết cộng hóa trị phân cực nên các phân tử ammonia dễ tạo liên kết hydrogen với nhau và với phân tử nước.
Ammonia tan nhiều trong nước.
Ở điều kiện thường, ammonia là chất khí không màu, có mùi khai, xốc và độc.
2. Tính chất hóa học
a) Tính base
Cặp electron hóa trị riêng trên nguyên tử nitrogen là nguyên nhân gây nên tính base của ammonia.
$NH_{3}(g)+H_{2}O(l)⇌NH_{4}^{+}+OH^{-}(aq)$
Khí ammonia hoặc dung dịch ammonia phản ứng với các acid tạo ra muối ammonium. Ví dụ:
$NH_{3}(aq)+HCl(aq)\rightarrow NH_{4}Cl(aq)$
Sự hình thành ion ammonium ở các phản ứng trên là do sự tạo thành liên kết cho – nhận giữa nguyên tử nitrogen của phân tử ammonia với H$^{+}$ (proton) của acid.
$NH_{3}+H^{+}\rightarrow NH_{4}^{+}$
Vì vậy, ammonia là một base theo thuyết Brosted – Lowry.
Ammonia là một base theo thuyết Bronsted – Lowry. Do đó, khi giấy quỳ tím ẩm tiếp xúc với khí ammonia thì giấy quỳ ẩm sẽ chuyển sang màu xanh.
b) Tính khử
Nguyên tử N trong phân tử NH$_{3}$ có số oxi hóa -3, là số oxi hóa thấp nhất của nguyên tố nitrogen trong các hợp chất. Vì vậy ammonia thể hiện tính khử khi phản ứng với một số chất có tính oxi hóa.
Ammonia là một base theo thuyết Bronsted – Lowry. Do đó, khi giấy quỳ tím ẩm tiếp xúc với khí ammonia thì giấy quỳ ẩm sẽ chuyển sang màu xanh.
3. Tổng hợp ammonia theo quá trình Haber
Trong công nghiệp, ammonia được tổng hợp theo quá trình Haber. Phương trình hóa học của phản ứng diễn ra như sau:
$N_{2}(g)+3H_{2}(g)\overset{t^{o},p,xt}{\rightleftharpoons }2NH_{3}(g)$
Dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier, cần chọn các điều kiện thích hợp về áp suất và nhiệt độ:
- Về áp suất: Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất của hệ, hay chiều tạo ammonia.
- Về nhiệt độ: Cần phải giảm nhiệt độ để cân bằng chuyển dịch theo chiều thuận, tạo ammonia.
Việc sử dụng xúc tác là bột sắt trong quá trình Haber có tác dụng làm cho phản ứng nhanh đạt đến trạng thái cân bằng.
Nhiệt độ hoá lỏng của N$_{2}$, H$_{2}$ và NH$_{3}$ lần lượt là: -196 °C, - 252,87 °C, -33 °C.
Do đó, nếu giữ nguyên áp suất và làm lạnh thiết bị thì khí NH3 sẽ hoá lỏng đầu tiên.
III. ỨNG DỤNG CỦA AMMONIA
Gần đây, mỗi năm có hàng trăm triệu tấn ammonia được sản xuất trên toàn cầu. Trong đó, có khoảng 80% được sử dụng cho sản xuất phân đạm để cung cấp nitrogen cho đất và cây trồng.
Ammonia còn là nguyên liệu quan trọng để sản xuất nitric acid, sản xuất một số chất gây nổ sử dụng trong khai thác quặng mỏ như ammonium nitrate,…
Ammonia lỏng được sử dụng với vai trò chất làm lạnh trong một số hệ thống làm lạnh công nghiệp.
II. MUỐI AMMONIUM
Tính chất vật lí:
Muối ammonium là các hợp chất có chứa ion ammonium ($NH_{4}^{+}$) và gốc acid. Các muối ammonium thường được sử dụng là: NH$_{4}$Cl, NH$_{4}$NO$_{3}$, (NH$_{4}$)$_{2}$CO$_{3}$, (NH$_{4}$)$_{2}$SO$_{4}$,…
Hầu hết các muối ammonium tan tốt và điện li hoàn toàn trong nước. Ví dụ:
$NH_{4}NO_{3}\rightarrow NH_{4}^{+}+NO_{3}$
Tính chất hóa học:
Khi đun nóng hỗn hợp muối ammonium và kiềm ở dạng rắn hoặc dung dịch đều sinh ra khí ammonia có mùi khai và xốc.
$2NH_{4}Cl(s)+Ca(OH)_{2}(s)\overset{t^{o}}{\rightarrow}2NH_{3}(g)+2H_{2}O(g)+CaCl_{2}(s)$
Các muối ammonium kém bền với nhiệt nên dễ bị phân hủy ở nhiệt độ cao.
Ví dụ: $NH_{4}NO_{3}\overset{t^{o}}{\rightarrow}N_{2}O+2H_{2}O$
Các phản ứng phân hủy muối ammonium đều làm tăng áp suất khí nên có nguy cơ cháy nổ.
$NH_{4}NO_{3}\overset{t^{o}}{\rightarrow}N_{2}O+2H_{2}O$; $\Delta _{r}H^{o}_{298}$ = -36kJ < 0
=> Phản ứng phân hủy ammonium nitrate tỏa nhiệt.
$NH_{4}Cl\rightarrow NH_{4}^{+}+Cl^{-}$; $\Delta _{r}H^{o}_{298}$ = 176kJ > 0
=> Phản ứng phân hủy ammonium chloridde thu nhiệt.
Vậy muối ammonium nitrate có nguy cơ cháy nổ cao hơn trong quá trình lưu trữ.
Ứng dụng:
- Muối ammonium được dùng làm phân bón trong nông nghiệp.
- Ngoài ra, ammonium chloride còn được sử dụng trong pin với vai trò chất điện li, hay dùng để làm sạch các oxide trên bề mặt của kim loại trước khi hàn.
IV. NGUỒN GỐC MỘT SỐ OXIDE CỦA NITROGEN TRONG KHÔNG KHÍ – MƯA ACID
1. Nguồn gốc một số oxide của nitrogen
Bầu khí quyển quanh ta có các oxide của nitrogen như NO, NO$_{2}$ (kí hiệu chung là NO$_{x}$).
Chúng được tạo ra từ quá trình tự nhiên, như sự tạo thành nitrogen monoxide trong khí quyển khi có sấm sét.
Ngoài ra, chúng cũng được tạo ra từ các hoạt động của con người.
2. Mưa acid
Nitrogen monoxide, nitrogen dioxide cùng với sulfur dioxide trong khí quyển là nguyên nhân chính dẫn tới sự có mặt của nitric acid và sulfuric acid hòa tan trong nước mưa.
Sự hình thành sulfuric dioxide trong nước mưa từ sulfur dioxide trong khí quyển như sau:
- Trước tiên, sulfur dioxide bị oxi hóa bởi oxygen
$SO_{2}+\frac{1}{2}O_{2}\rightarrow SO_{3}$
- Tiếp theo, sulfur trioxide (SO$_{3}$) kết hợp với nước mưa để hình thành sulfuric acid.
$SO_{3}+H_{2}O\rightarrow H_{2}SO_{4}$
Acid trong nước mưa ($H_{2}SO_{4},HNO_{3}$) sẽ làm giảm pH của đất và nước. Các acid này cũng ăn mòn các kết cấu kim loại, biến đổi thành phần vật liệu của các công trình.
V. NITRIC ACID
Công thức Lewis của nitric acid như sau:
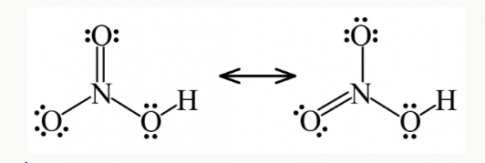
Nitric acid là chất lỏng không màu, có tính acid mạnh và tính oxi hóa mạnh.
Số oxi hóa của nitrogen trong mỗi phân tử và ion lần lượt là: -3; -3; 0; +1; +2; +4; +3; +5.
Công thức Lewis của HNO3 theo đề bài là không phù hợp, do N ở chu kì 2, không có AO d trống.
Ứng dụng:
- Mỗi năm có hàng chục triệu tấn nitric acid được sản xuất trên toàn cầu. Trong đó, khoảng 80% được dùng cho sản xuất phân đạm ammonium nitrate.
- Dựa vào tính oxi hóa mạnh, nitric acid còn được dùng trong ngành công nghiệp luyện kim, trong các quy trình phân tích mẫu,…
VI. HIỆN TƯỢNG PHÚ DƯỠNG
Hiện tượng phú dưỡng là sự tích tụ lượng lớn các chất dinh dưỡng, bao gồm những hợp chất của nitrogen và hợp chất của phosphorus trong các nguồn nước.
Có thể quan sát được hiện tượng phú dưỡng thông qua sự xuất hiện dày đặc của tảo xanh trong nước. Khi đó lượng oxygen trong nước sẽ nhanh chóng giảm đi.
Để hạn chế hiện tượng phú dưỡng, cần:
- Tạo điều kiện để nước trong kênh, rạch, ao, hồ được lưu thông.
- Xử lí nước thải trước khi cho chảy vào kệnh, rạch, ao, hồ.
- Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận