Lý thuyết trọng tâm hóa học 10 cánh diều bài 12: Liên kết hydrogen và tương tác Van der Waals
Tổng hợp kiến thức trọng tâm hóa học 10 cánh diều bài 12: Liên kết hydrogen và tương tác Van der Waals. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. LIÊN KẾT HYDROGEN
1. Khái niệm
Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng. Các nguyên tử có độ âm điên lớn thường gặp trong liên kết hydrogen là N, O, F.
- Phân tử HF:

- Phân tử NH$_{3}$:

- Phân tử H$_{2}$O

- Phân tử H$_{2}$O với phân tử NH$_{3}$
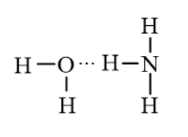
Cách tạo thành liên kết hydrogen: Nguyên tử hydrogen trong các phân tử HF, NH$_{3}$, H$_{2}$O rất linh động, có điện tích dương đủ lớn để hút các electron hóa trị chưa tham gia liên kết trên nguyên tử F, N, O (của phân tử khác) có độ âm điện lớn tạo thành liên kết hydrogen.
2. Ảnh hưởng của liên kết hydrogen tới chất vật lí của nước
a) Đặc điểm tập hợp
Nhờ liên kết hydrogen, các phân tử nước có thể tập hợp với nhau ngay cả thể hơi, thành một cụm phân tử có kích thước khác nhau:
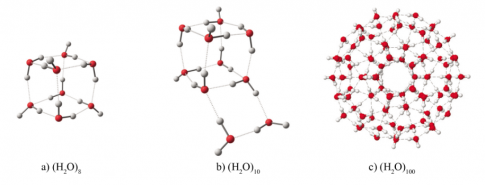
Liên kết hydrogen ảnh hưởng đến tính chất của nước đá. Một phân tử nước có thể tạo ra 4 liên kết hydrogen với các phân tử nước khác xung quanh tạo thành cấu trúc tứ diện. Mạng tinh thể nước đá có vô số cấu trúc như vậy. Cấu trúc này khác rỗng nên nước đá nhẹ hơn nước lỏng và có thể nổi một phần trên bề mặt nước lỏng.
b) Nhiệt độ nóng chảy, nhiệt độ sôi
Nhiệt độ sôi của H$_{2}$O cao hơn hẳn so với H$_{2}$S và CH$_{4}$ do ảnh hưởng của liên kết hydrogen.
- Liên kết hydrogen của H$_{2}$O bền hơn.
- Sự phân cực liên kết trong H$_{2}$O lớn hơn.
Liên kết hydrogen giữa các phân tử nước tạo nên sức căng bề mặt rất lớn. Đôi chân của nhện có thể tạo ra chỗ trũng tới 4 milimet và vẫn không phá vớ được sức căng bề mặt của nước. Nên nhện có thể chạy được trên nước.
H$_{2}$O có khối lượng phân tử thấp hơn so với C$_{2}$H$_{5}$OH nhưng các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết hydrogen.
=> Nhiệt độ sôi của nước cao hơn C$_{2}$H$_{5}$OH.
=> Khi chưng cất rượu, C$_{2}$H$_{5}$OH có điểm sôi thấp hơn nước sẽ bay hơi trước.
Kết luận:
Liên kết hydrogen có ảnh hưởng đến tính chất vật lí của nước.
Liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi, sức căng bề mặt… của các chất có liên kết hydrogen.
Vì có liên kết hydrogen nên nhiệt độ sôi của nước cao hơn nhiều so với H$_{2}$S và CH$_{2}$4
II. TƯƠNG TÁC VAN DER WAALS
1. Khái niệm tương tác van der Waals.
Liên kết van der Waals là một loại liên kết yếu, hình thành do tương tác hút tĩnh điện giữa các cực trái dấu của phân tử.

2. Ảnh hưởng của tương tác van der Waals tới tính chất vật lý của các chất
Các phân tử F$_{2}$, Cl$_{2}$ là những chất khí còn Br$_{2}$ là chất lỏng vì giữa các phân tử Br$_{2}$ tồn tại một tương tác yếu
Ở nhiệt độ thường O$_{2}$ là chất khí. Tuy nhiên ở nhiệt độ thấp, giữa các phân tử O$_{2}$ tồn tại một tương tác yếu để giữ các phân tử lại với nhau trong trạng thái lỏng.
Sự hình thành tương tác van der Waals: Các nguyên tử khí hiếm hoặc các chất cộng hóa trị không phân cực, do đám mây electron luôn chuyển động nên cũng có thể tạo ra một lưỡng cực tạm thời. Lực hút giữa một đầu mang một phần điện tích âm của lưỡng cực trong phân tử này và một đầu mang một phần điện tích dương của lưỡng cực trong phân tử khác tạo thành tương tác van der Walls.
- Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron trong phân tử và khối lượng phân tử tăng, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các halogen.
- Đồng phân mạch không phân nhánh pentane có nhiệt độ sôi (36 °C) cao hơn so với đồng phân mạch phân nhánh neopentane (9,5 °C) do diện tích tiếp xúc giữa các phân tử pentane lớn hơn nhiều so với neopentane.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây

Bình luận