Slide bài giảng Vật lí 12 chân trời Bài 6: Định luật Boyle. Định luật Charles
Slide điện tử Bài 6: Định luật Boyle. Định luật Charles. Trình bày với các hiệu ứng hiện đại, hấp dẫn. Giúp học sinh hứng thú học bài. Học nhanh, nhớ lâu. Có tài liệu này, hiệu quả học tập của môn Vật lí 12 Chân trời sẽ khác biệt
Bạn chưa đủ điều kiện để xem được slide bài này. => Xem slide bài mẫu
Tóm lược nội dung
BÀI 6. ĐỊNH LUẬT BOYLE. ĐỊNH LUẬT CHARLES
MỞ ĐẦU
Câu hỏi: Để đưa thuốc từ lọ vào trong xilanh của ống tiêm, ban đầu nhân viên y tế đẩy pit-tông sát đầu trên của xilanh, sau đó đưa đầu kim tiêm (được gắn với ống tiêm) vào trong lọ thuốc. Khi kéo pit-tông, thuốc sẽ chảy vào trong xilanh (Hình 6.1). Quá trình lấy máu dùng trong xét nghiệm tại các cơ sở y tế cũng hoàn toàn tương tự. Ứng dụng trên dựa vào các định luật của chất khí. Vật, đó là những định luật nào?
Trả lời rút gọn:
Định luật Boyle và định luật Charles.
1. TRẠNG THÁI VÀ QUÁ TRÌNH BIẾN ĐỔI TRẠNG THÁI CỦA KHÍ
2. ĐỊNH LUẬT BOYLE
Thảo luận 1: Dự đoán mối liên hệ giữa áp suất và thể tích khí nén pit-tông xuống hoặc kéo pit-tông lên.
Trả lời rút gọn:
Mối liên hệ giữa thể tích và áp suất: tỉ lệ nghịch.
Thảo luận 2: Tiến hành thí nghiệm theo các bước hướng dẫn, từ đó tính toán và kiểm tra biểu thức dự đoán, rút ra kết luận về mối liên hệ giữa p và V.
Trả lời rút gọn:
Kết luận: p và V tỉ lệ nghịch với nhau theo biểu thước pV = hằng số.
Thảo luận 3: Từ số liệu Bảng 6.1, vẽ đồ thị biểu diễn mối liên hệ giữa p và V trong hệ tọa độ p - V và p - ![]() . Nhận xét về dạng đồ thị.
. Nhận xét về dạng đồ thị.
Trả lời rút gọn:
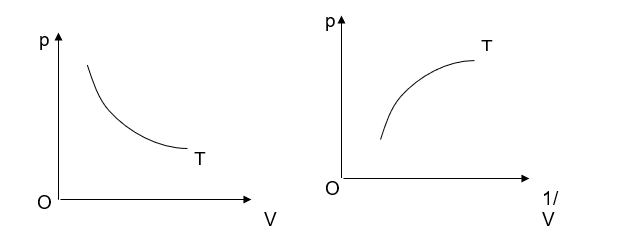
Nhận xét: Đồ thị có hình dạng hypebol.
Thảo luận 4: Từ Hình 6.4, chứng minh rằng T2 > T1.
Trả lời rút gọn:
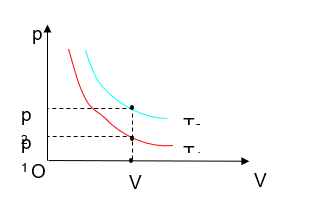
Tại điểm V (V = hằng số), ứng với trục p, ta có p1 < p2.
Phương trình khí: pV = nRT → khi cùng điều kiện, cùng số mol khí mà thể tích không đổi, áp suất tăng thì nhiệt độ cũng tăng.
Do đó, p2 > p1 → T2 > T1
Luyện tập: Nén đẳng nhiệt một khối khí từ thể tích ban đầu 9 lít xuống còn 4 lít. Áp suất của khối khí sau khi nén tăng hay giảm bao nhiêu lần.
Trả lời rút gọn:
Áp dụng định luật Boyle, khi nhiệt độ không đổi có: pV = hằng số
→ p1V1 = p2V2 → ![]()
Vậy, áp suất khối khí sau khi nén tăng lên 2,25 lần
Vận dụng: Dựa vào định luật Boyle, giải thích tại sao có thể rút thuốc (thể lỏng) từ trong lọ thuốc vào xilanh của ống tiêm khi nhân viên y tế kéo pit-tông như Hình 6.1.
Trả lời rút gọn:
Theo định luật Boyle, áp suất khí trong xilanh sẽ giảm xuống thấp hơn so với áp suất ban đầu (áp suất môi trường), tạo ra sự chênh lệch áp suất. Do đó, chất lỏng sẽ dịch chuyển từ nơi có áp suất cao (lọ thuốc) đến nơi có áp suất thấp (xilanh) giúp ta lấy được thuốc trong lọ.
3. ĐỊNH LUẬT CHARLES
Thảo luận 5: Tiến hành thí nghiệm theo các bước hướng dẫn, thu thập số liệu T, V trong các lần đo. Từ đó:
Vẽ đồ thị V theo T trong hệ trục tọa độ V - T, nhận xét dạng đồ thị.
Rút ra mối liên hệ giữa V và T trong quá trình biến đổi đẳng áp.
Trả lời rút gọn:
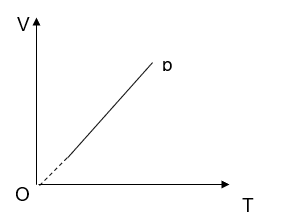
Hình dạng đồ thị: Đường thẳng
Mối liên hệ giữa V và T: tỷ lệ thuận
Thảo luận 6: Dựa vào thuyết động học phân tử chất khí, hãy giải thích vì sao đường đẳng áp p2 lại ở trên đường đẳng áp p1 trong Hình 6.7.
Trả lời rút gọn:
Ở cùng một thể tích, khi nhiệt độ tăng, các phân tử khí sẽ chuyển động nhanh hơn, va chạm vào thành bình chứa nhiều hơn, tạo ra áp suất khí lên thành bình lớn hơn. Do đó, p1 > p2.
Luyện tập: Cho một khối khí dãn nở đẳng áp từ nhiệt độ t1 = 32oC đến nhiệt độ t2 = 117oC, thể tích khối khí tăng thêm 1,7 lít. Xác định thể tích khối khí trước và sau khi dãn nở.
Trả lời rút gọn:
Ta có: V2 = V1 + 1,7
Theo định luật Charles: ![]()
→ ![]() →
→ ![]() → V1 = 6,1 (lít)
→ V1 = 6,1 (lít)
V2 = 6,1 + 1,7 = 7,8 (lít)
BÀI TẬP
Bài 1:Hình nào dưới đây mô tả quá trình đẳng áp của một khối lượng khí xác định?

Trả lời rút gọn:
Đáp án D.
Bài 2:Một khối khí xác định dãn nở đẳng nhiệt từ thể tích ban đầu 5 lít đến 12 lít thì áp suất khối khí đã giảm một lượng 80 kPa. Áp suất ban đầu của khối khí bằng bao nhiêu?
Trả lời rút gọn:
Ban đầu: V1 = 5 lít, p1;
Lúc sau: V2 = 12 lít, p2 = p1 - 80
Theo định luật Boyle, ta có: pV = hằng số
→ p1V1 = p2V2
→ p1.5 = (p1 - 80).12
→ p1 = 137, 14 kPa
Bài 3:Một mô hình áp kế khí (Hình 6P.1) gồm một bình cầu thủy tinh có thể tích 270 cm3 gắn với một ống nhỏ AB nằm ngang có tiết diện 0,1 cm2. Trong ống có một giọt thủy ngân. Ở 0oC giọt thủy ngân cách A 30 cm. Tính khoảng di chuyển của giọt thủy ngân khi hơ nóng bình cầu đến 10oC. Coi thể tích bình là không đổi.
Trả lời rút gọn:
Tại 0oC: V1 = 270 + 0,1.30 = 273 cm3; T1 = 273K
Tại 10oC: V2 = 270 + 0,1.s, T2 = 283K
Vì áp suất không đổi, áp dụng định luật Charles có: ![]() = hằng số
= hằng số
→ ![]() →
→ ![]() → s = 130 (cm)
→ s = 130 (cm)
Bài 4:Vào những ngày trời nắng nóng, nhiệt độ không khí ngoài sân là 42oC, trong khi nhiệt độ không khí trong nhà là 27oC. Xem áp suất không khí trong nhà và ngoài sân là như nhau. Khối lượng riêng của không khí trong nhà lớn hơn khối lượng riêng của không khí ngoài sân bao nhiêu lần?
Trả lời rút gọn:
Ở ngoài sân có: T1 = 42oC
Trong nhà có: T2 = 27oC
Vì áp suất không đổi, theo định luật Charles có: ![]() →
→ ![]()
Ta có: d = ![]() . Với m không đổi, có
. Với m không đổi, có ![]() =
= ![]() =
= ![]()
Vậy, khối lượng riêng của không khí trong nhà lớn gấp 1,05 lần không khí ngoài sân.
