Hãy tính tốc độ trung bình của phản ứng (1) trong khoảng thời gian từ 0 đến 20 giây theo thể tích CO2.
II. Mô phỏng thí nghiệm hoá học
1. Dùng thí nghiệm thiết kết sẵn
Câu hỏi 1: Hãy tính tốc độ trung bình của phản ứng (1) trong khoảng thời gian từ 0 đến 20 giây theo thể tích CO2.
Câu hỏi 2: Khi khí thoát ra, các quả bóng to dần lên. Hãy quan sát tốc độ tăng dần kích thước của các quả bóng và cho biết tốc độ thoát khí CO2 ở ống nghiệm nào nhanh nhất, ở ống nghiệm nào chậm nhất? Nồng độ ảnh hưởng như thế nào đến tốc độ phản ứng?
Câu hỏi 3: Sử dụng thẻ Open-local để mô phỏng các thí nghiệm sau:
- Thí nghiệm ảnh hưởng của nhiệt độ đến tốc độ của phản ứng (giữa CaCO3(s) và HCl(aq)).
- Thí nghiệm ảnh hưởng của chất xúc tác MnO2 đến tốc độ phản ứng phân hủy H2O2(aq).
2. Tự thiết kế mô phỏng thí nghiệm
Câu hỏi 4: Nêu hiện tượng và viết phương trình hóa học của phản ứng giữa copper và nitric acid.
Câu hỏi 1:
Từ đồ thị ta thấy, sau 20s thì thể tích khí thoát ra là 86,5 $cm^{3}$.
⇒ Tốc độ trung bình của phản ứng (1) trong khoảng thời gian từ 0 đến 20 giây theo thể tích CO2 là: (86,5−0) : 20 = 4,325 $cm^{3}$/s
Câu hỏi 2:
- Quả bóng bay ở ống nghiệm chứa dung dịch acid 2M to dần lên nhanh nhất và nổ sớm nhất. Chứng tỏ tốc độ thoát khí CO2 ở ống nghiệm có nồng độ acid 2M là nhanh nhất.
- Quả bóng bay ở ống nghiệm chứa dung dịch acid 1M to lên chậm nhất và nổ muộn nhất. Chứng tỏ tốc độ thoát khí CO2 ở ống nghiệm có nồng độ acid 1M là chậm nhất.
⇒ Nồng độ của các chất tham gia càng lớn thì tốc độ phản ứng càng lớn.
Câu hỏi 3:
- Thí nghiệm ảnh hưởng của nhiệt độ đến tốc độ của phản ứng (giữa CaCO3(s) và HCl(aq)).
Bước 1: Khởi động phần mềm Yenka.
Bước 2: Chọn Open - local ⟶ Temperature and rate
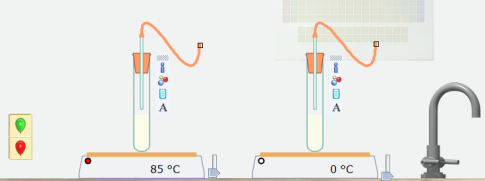
Bước 3: Nháy chuột vào các quả bóng có màu khác nhau, kéo thả vào cuối ống dẫn khí ở các ống nghiệm có nồng độ khác nhau.

Bước 4: Nháy chuột vào nút Pause để thực hiện mô phỏng. Sau khoảng 6 giây nháy chuột lại vào nút Pause để dừng mô phỏng.

Kết quả:
Phương trình hóa học của phản ứng:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
Quả bóng ở ống nghiệm được đun nóng đến 85 độ C to lên nhanh hơn. Chứng tỏ nhiệt độ càng cao thì tốc độ phản ứng càng lớn.
- Thí nghiệm ảnh hưởng của chất xúc tác MnO2 đến tốc độ phản ứng phân hủy H2O2(aq).
Bước 1: Khởi động phần mềm Yenka.
Bước 2: Chọn Open -local ⟶ Catalysts and rate.
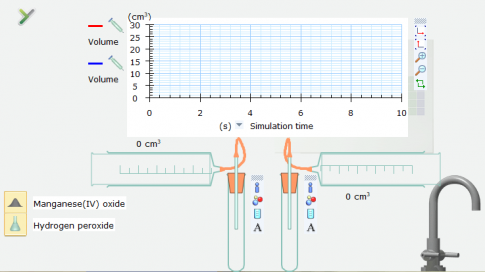

Bước 3: Nháy chuột trái vào dòng chữ chỉ hóa chất Hydrogen peroxide rồi kéo thả lần lượt vào 2 ống nghiệm (Test tube), sau đó kéo thả hoá chất Manganeses(IV) oxide vào 1 trong 2 ống nghiệm.
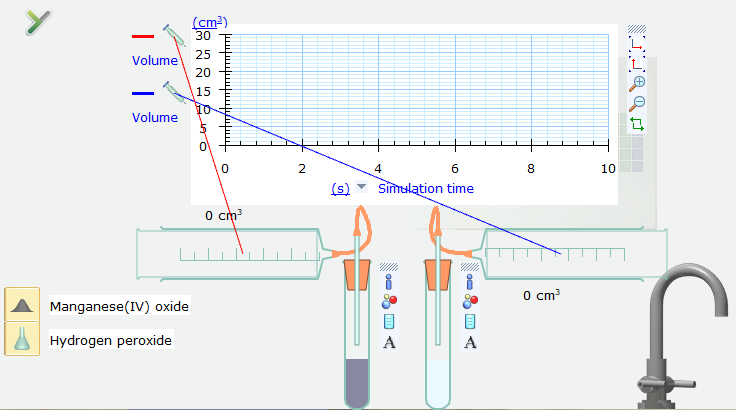
Bước 4. Nháy chuột vào nút Pause ở góc dưới bên phải của màn hình mô phỏng để thực hiện mô phỏng. Sau khoảng 1 giây trên trục thời gian mô phỏng, nháy chuột lại vào nút Pause để dừng mô phỏng.
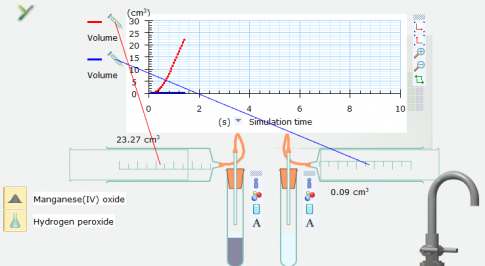
Kết quả cho thấy có khí thoát ra ngay ở ống nghiệm chứa xúc tác manganeses(IV) oxide. Còn ống nghiệm không có xúc tác manganeses(IV) oxide chưa có khí thoát ra. Chứng tỏ chất xúc tác làm tăng tốc độ phản ứng.
Câu hỏi 4:
Hiện tượng: Có khí thoát ra và dung dịch có màu xanh.
Phương trình hóa học: 8HNO3 + 3Cu ⟶ 3Cu(NO3)2 + 2NO + 4H2O

Bình luận