Bộ câu hỏi ôn tập Hoá học 9 kết nối tri thức mới
Dưới đây là bộ câu hỏi ôn tập chương trình mới môn Khoa học tự nhiên 9 (Hoá học) kết nối tri thức. Nhiều dạng bài tập, câu hỏi hay, tổng hợp kiến thức trọng tâm của bài học giúp học sinh ôn tập, nắm chắc kiến thức, đạt thành tích tốt trong học tập. Mời thầy cô và các em kéo xuống tham khảo.
CHƯƠNG VI. KIM LOẠI. SỰ KHÁC NHAU CƠ BẢN GIỮA PHI KIM VÀ KIM LOẠIBÀI 18: TÍNH CHẤT CHUNG CỦA KIM LOẠI
GIỮA PHI KIM VÀ KIM LOẠIBÀI 18: TÍNH CHẤT CHUNG CỦA KIM LOẠI
BÀI 18: TÍNH CHẤT CHUNG CỦA KIM LOẠI
(15 CÂU)
1. NHẬN BIẾT (4 CÂU)
Câu 1: Hãy cho biết các tính chất vật lí chung của kim loại.
Trả lời:
Kim loại có các tính chất vật lí chung như sau:
- Tính dẻo.
- Tính dẫn điện, dẫn nhiệt.
- Ánh kim.
Câu 2: Hãy cho biết khả năng tác dụng với phi kim của kim loại. Viết phương trình hóa học minh họa.
Trả lời:
- Tác dụng với oxygen: Hầu hết các kim loại (trừ Au,…) phản ứng với khí oxygen tạo thành oxide kim loại.
Ví dụ: 3Fe + 2O2 ![]() Fe3O4
Fe3O4
- Tác dụng với phi kim khác: Kim loại có thể tác dụng với nhiều phi kim tạo thành muối.
Ví dụ: Cu + Cl2 ![]() CuCl2
CuCl2
Câu 3: So sánh khả năng tác dụng với nước của K, Zn và Au. Viết phương trình hóa học minh họa (nếu có).
Trả lời:
- K tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen, phản ứng tỏa ra nhiều nhiệt.
Ví dụ: 2K + 2H2O → 2KOH + H2
- Zn tác dụng với hơi nước ở nhiệt độ cao tạo thành oxide và khí hydrogen.
Ví dụ: Zn + H2O ![]() ZnO + H2
ZnO + H2
- Au không tác dụng với nước.
Câu 4: Hãy cho biết cơ chế của phản ứng giữa kim loại với dung dịch muối.
Trả lời:
Kim loại hoạt động hóa học mạnh đẩy kim loại hoạt động hóa học yếu hơn ra khỏi muối.
2. THÔNG HIỂU (6 CÂU)
Câu 1: Tại sao vàng để lâu trong không khí vẫn sáng đẹp?
Trả lời:
Vì vàng không tác dụng với khí oxygen trong không khí nên vẫn giữ được tính ánh kim
Câu 2: Cho biết hiện tượng khi cho dây sắt được đốt nóng tác dụng với khí chlorine. Viết phương trình hóa học minh họa.
Trả lời:
- Hiện tượng: Sắt cháy trong khí chlorine tạo thành muối iron (III) chloride màu nâu đỏ.
Phương trình: 2Fe + 3Cl2 ![]() 2FeCl3
2FeCl3
Câu 3: Hãy nêu một số ứng dụng của kim loại trong đời sống.
Trả lời:
- Vàng được dùng làm đồ trang sức.
- Đồng được dùng làm lõi dây điện.
- Nhôm được dùng làm xoong, nồi, chảo.
- Thép được dùng trong xây dựng, cầu đường,…
Câu 4: Quan sát Hình 18.3, mô tả quá trình và hiện tượng xảy ra.
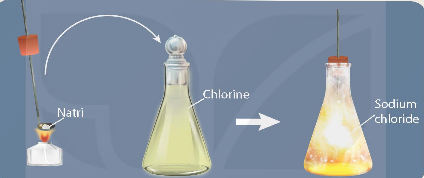
Trả lời:
Đun nóng chảy một mẩu natri rồi đưa nhanh vào bình khí chlorine có màu vàng lục, natri cháy trong khí chlorine tạo thành tinh thể muối ăn có màu trắng.
Câu 5: Hãy đề xuất phương pháp hóa học phân biệt Na và Ag. Viết phương trình hóa học minh họa (nếu có).
Trả lời:
- Thả 2 kim loại trên vào nước, kim loại tan trong nước là Na, Ag không tan trong nước.
Phương trình: 2Na + 2H2O → 2NaOH + H2
Câu 6: Một trong những cách nhận biết trang sức được làm bằng vàng thật hay vàng giả là sử dụng bông gòn thấm dung dịch nitric acid rồi bôi lên bề mặt vàng. Hãy cho biết các trường hợp có thể xảy ra. Chỉ ra trường hợp nào là vàng thật, trường hợp nào là vàng giả và giải thích.
Trả lời:
Có 2 trường hợp có thể xảy ra:
- Khi bề mặt trang sức gặp dung dịch acid, nếu tạo ra nước và muối ⇒ vàng giả.
- Khi bề mặt trang sức gặp dung dịch acid, nếu không có hiện tượng gì xảy ra ⇒ vàng thật.
Giải thích: Vì vàng không tác dụng với dung dịch acid.
3. VẬN DỤNG (3 CÂU)
Câu 1: Nung 6,4 gam Cu ngoài không khí thu được 6,4 gam CuO. Hiệu suất của phản ứng là bao nhiêu?
Trả lời:
Ta có: ![]()
Phương trình hóa học:
2Cu + O2![]() 2CuO
2CuO
0,1 → 0,1 mol
Khối lượng CuO theo lí thuyết tạo thành là:
![]()
Hiệu suất phản ứng tính theo CuO là:
H = ![]()
Câu 2: Cho vào dung dịch HCl một cây đinh sắt. Sau một thời gian phản ứng thu được 0,5 mol khí hydrogen. Hãy tính khối lượng sắt đã phản ứng.
Trả lời:
Phương trình hóa học: Fe + 2HCl → FeCl2 + H2
0,5 ← 0,5 mol
Ta có: ![]()
Câu 3: Cho 9,6 gam kim loại Mg vào 120 gam dung dịch HCl (vừa đủ). Tính nồng độ phần trăm của dung dịch sau phản ứng.
Trả lời:
Ta có: ![]()
Phương trình hóa học: Mg + 2HCl → MgCl2 + H2
0,4 → 0,4 0,4 mol
Dung dịch sau phản ứng chứa MgCl2: 0,4 mol.
Khối lượng của MgCl2 là: ![]()
Áp dụng định luật bảo toàn khối lượng, khối lượng của dung dịch sau phản ứng là:
![]()
⇒ ![]() = 128,8 (gam).
= 128,8 (gam).
Phần trăm dung dịch sau phản ứng là:
C% = ![]()
4. VẬN DỤNG CAO (2 CÂU)
Câu 1: Hòa tan hết 12 gam một kim loại hóa trị II bằng dung dịch H2SO4 loãng thu được 0,3 mol khí H2. Hãy xác định kim loại trên.
Trả lời:
Gọi kim loại cần tìm là A.
Phương trình hóa học: A + H2SO4(l) → ASO4 + H2
0,3 ← 0,3 mol
Ta có ![]()
Vậy kim loại cần tìm là Ca.
Câu 2: Trong hợp chất oxide của A, oxygen chiếm 17,02% theo khối lượng. Hãy xác định kim loại A.
Trả lời:
Giả sử kim loại A có hóa trị n ⇒ Công thức oxide của kim loại A là A2On.
Trong hợp chất oxide, oxygen chiếm 17,02% về khối lượng nên:
%![]() ⇒ 17,02% =
⇒ 17,02% = ![]() .
.
⇒ 16n = 0,1702.(2.MA + 16n) ⇒ MA = 39n.
Ta có bảng sau:
N | 1 | 2 | 3 | 4 |
MA | 39 (K) | 78 (loại) | 117 (loại) | 156 (loại) |
Vậy A là K.
Thêm kiến thức môn học
Giải bài tập những môn khác
Môn học lớp 9 KNTT
5 phút giải toán 9 KNTT
5 phút soạn bài văn 9 KNTT
Văn mẫu 9 kết nối tri thức
5 phút giải KHTN 9 KNTT
5 phút giải lịch sử 9 KNTT
5 phút giải địa lí 9 KNTT
5 phút giải hướng nghiệp 9 KNTT
5 phút giải lắp mạng điện 9 KNTT
5 phút giải trồng trọt 9 KNTT
5 phút giải CN thực phẩm 9 KNTT
5 phút giải tin học 9 KNTT
5 phút giải GDCD 9 KNTT
5 phút giải HĐTN 9 KNTT
Môn học lớp 9 CTST
5 phút giải toán 9 CTST
5 phút soạn bài văn 9 CTST
Văn mẫu 9 chân trời sáng tạo
5 phút giải KHTN 9 CTST
5 phút giải lịch sử 9 CTST
5 phút giải địa lí 9 CTST
5 phút giải hướng nghiệp 9 CTST
5 phút giải lắp mạng điện 9 CTST
5 phút giải cắt may 9 CTST
5 phút giải nông nghiệp 9 CTST
5 phút giải tin học 9 CTST
5 phút giải GDCD 9 CTST
5 phút giải HĐTN 9 bản 1 CTST
5 phút giải HĐTN 9 bản 2 CTST
Môn học lớp 9 cánh diều
5 phút giải toán 9 CD
5 phút soạn bài văn 9 CD
Văn mẫu 9 cánh diều
5 phút giải KHTN 9 CD
5 phút giải lịch sử 9 CD
5 phút giải địa lí 9 CD
5 phút giải hướng nghiệp 9 CD
5 phút giải lắp mạng điện 9 CD
5 phút giải trồng trọt 9 CD
5 phút giải CN thực phẩm 9 CD
5 phút giải tin học 9 CD
5 phút giải GDCD 9 CD
5 phút giải HĐTN 9 CD
Trắc nghiệm 9 Kết nối tri thức
Trắc nghiệm 9 Chân trời sáng tạo
Trắc nghiệm 9 Cánh diều
Tài liệu lớp 9
Văn mẫu lớp 9
Đề thi lên 10 Toán
Đề thi môn Hóa 9
Đề thi môn Địa lớp 9
Đề thi môn vật lí 9
Tập bản đồ địa lí 9
Ôn toán 9 lên 10
Ôn Ngữ văn 9 lên 10
Ôn Tiếng Anh 9 lên 10
Đề thi lên 10 chuyên Toán
Chuyên đề ôn tập Hóa 9
Chuyên đề ôn tập Sử lớp 9
Chuyên đề toán 9
Chuyên đề Địa Lý 9
Phát triển năng lực toán 9 tập 1
Bài tập phát triển năng lực toán 9

Bình luận