Lý thuyết trọng tâm hóa học 11 cánh diều bài 12: Alkane
Tổng hợp kiến thức trọng tâm hóa học 11 cánh diều bài 12: Alkane. Tài liệu nhằm củng cố, ôn tập lại nội dung kiến thức bài học cho học sinh dễ nhớ, dễ ôn luyện. Kéo xuống để tham khảo
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
I. KHÁI NIỆM VÀ DANH PHÁP
1. Khái niệm
Alkane là hydrocarbon mạch hở, trong phân tử chỉ có liên kết đơn
Alkane có công thức chung là $C_{n}H_{2n+2}$ (với n 1)
2. Đồng phân
Các alkane có từ bốn nguyên tử C trở lên có đồng phân về mạch carbon.
Các alkane mạch không phân nhánh có mạch carbon mà trong đó mỗi nguyên tử carbon chỉ liên kết với tối đa hai nguyên tử carbon khác.
Ví dụ: CH3-CH2-CH2-CH3
Alkane mạch phân nhánh chứa nguyên tử carbon liên kết với ba hoặc bốn nguyên tử carbon khác
Ví dụ:

3. Danh pháp
Theo danh pháp thay thế, tên của alkane gồm hai phần: phần đầu (tiền tố) liên quan đến số lượng nguyên tử carbon trong mạch carbon của alkane; phần sau (hậu tố) là -ane với ý nghĩa chỉ hydrocarbon no.
Với alkane mạch phân nhánh, mạch carbon dài nhất là mạch chính; mạch carbon còn lại là mạch nhánh. Mạch nhánh còn lại được xem là nhóm thế alkyl của mạch chính. Đánh số các nguyên tử carbon trên mạch chính xuất phát từ đầu gần mạch nhánh nhất để tổng số chỉ vị trí của các nhánh là nhỏ nhất.
Tên alkane mạch phân nhánh = Vị trí nhóm thế alkyl -tên của nhóm thế alkyl tên alkane mạch chính
Trong đó, vị trí nhóm thế alkyl là vị trí của nguyên tử carbon trong mạch chính liên kết với nhóm thế đó
Tên của nhóm thế alkyl được hình thành bằng cách thêm hậu tố -yl vào sau phần tiền tố chỉ số nguyên tử carbon có trong nhóm thế. Nếu có nhiều nhóm thế giống nhau thì thêm “di” (nếu có 2 nhóm thế), “tri” (nếu có 3 nhóm), “tetra” (nếu có 4 nhóm),... vào trước tên gọi của nhóm thế
II. TÍNH CHẤT VẬT LÍ
Ở điều kiện thường, methane, ethane, propane và butane là các chất khí; các alkane có số nguyên tử carbon lớn hơn (trừ neopentane) là chất lỏng hoặc chất rắn.
Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của các alkane nhìn chung đều tăng theo khối lượng phân tử của chúng.
Tất cả các alkane đều nhẹ hơn nước
Alkane thuộc loại hợp chất hữu cơ kém phân cực, do đó chúng đều kém tan trong nước và tan nhiều trong dung môi hữu cơ không phân cực.
III. TÍNH CHẤT HOÁ HỌC
Ở điều kiện thường, methane, ethane, propane và butane là các chất khí; các alkane có số nguyên tử carbon lớn hơn (trừ neopentane) là chất lỏng hoặc chất rắn.
Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của các alkane nhìn chung đều tăng theo khối lượng phân tử của chúng.
Tất cả các alkane đều nhẹ hơn nước
Alkane thuộc loại hợp chất hữu cơ kém phân cực, do đó chúng đều kém tan trong nước và tan nhiều trong dung môi hữu cơ không phân cực.
1. Phản ứng thế halogen
Điều kiện: chiếu sáng hoặc đun nóng
Đặc điểm các chất sản phẩm: các nguyên tử hydrogen trong phân tử alkane dần bị thay thế bởi các nguyên tử halogen, lần lượt tạo thành các dẫn xuất halogen.
Ví dụ 4 (SGK trang 77):
CH4 + Cl2 $\overset{as}{\rightarrow}$ CH3Cl (chloromethane) + HCl
CH3Cl + Cl2 $\overset{as}{\rightarrow}$ CH2Cl (dichloromethane) + HCl
CH2Cl2 + Cl2 $\overset{as}{\rightarrow}$ CHCl3 (trichloromethane/chloroform) + HCl
CHCl3 + Cl2 $\overset{as}{\rightarrow}$ CCl4 (tetrachloromethane/carbon tetrachloride) + HCl
Nguyên tử H ở carbon bậc cao hơn dễ bị thế bởi nguyên tử halogen hơn so với nguyên tử H ở carbon bậc thấp hơn.
Ví dụ 5 (SGK trang 77):

2. Phản ứng cracking và phản ứng reforming
Điều kiện phản ứng cracking và reforming: nhiệt độ cào và có mặt chất xúc tác thích hợp.
Đặc điểm các chất sản phẩm:
- Phản ứng cracking: sản phẩm là những hợp chất có mạch carbon ngắn hơn
Ví dụ 6 (SGK trang 77):
C16H34 $\overset{t^{o},xt}{\rightarrow}$ C10H22 + C6H12
- Phản ứng reforming: sản phẩm có nhiều mạch nhánh hơn hoặc mạch vòng
Ví dụ 7 (SGK trang 77):
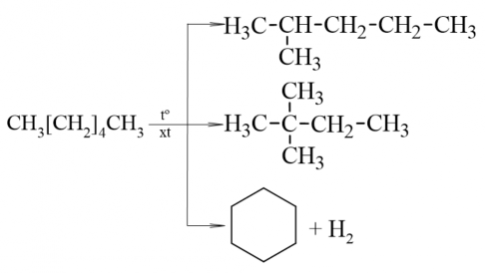
3. Phản ứng oxi hóa
Phản ứng oxi hóa: Ở nhiệt độ cao, các alkane bị oxi hóa với oxygen xảy ra phản ứng oxi hóa hoàn toàn (tạo thành carbon dioxide) hay phản ứng oxi hóa không hoàn toàn (tạo thành carbon monoxide hoặc carbon)
Ví dụ 8 (SGK trang 78):
C4H10 + $\frac{13}{2}$O2 $\overset{t^{o}}{\rightarrow}$ 4CO2 + 5H2O
C4H10 + $\frac{9}{2}$O2 $\overset{t^{o}}{\rightarrow}$ 4CO + 5H2O
C4H10 + $\frac{5}{2}$O2 $\overset{t^{o}}{\rightarrow}$ 4C + 5H2O
IV. NGUỒN ALKANE TRONG TỰ NHIÊN, ỨNG DỤNG CỦA ALKANE
1. Nguồn alkane trong tự nhiên – Điều chế alkane trong công nghiệp
- Alkane có trong dầu mỏ, khí thiên nhiên (methane là thành phần chủ yếu), khí mỏ dầu
- Sản xuất trong công nghiệp: lấy từ dầu mỏ, khí thiên nhiên, khí mỏ dầu.
2. Ứng dụng
- Alkane là thành phần chính của các loại nhiên liệu trong đời sống
- Methane được sử dụng làm nguyên liệu để tổng hợp acetylene, hydrogen
- Một số alkane được sử dụng làm nhiên liệu, dung môi pha sơn, chiết tách chất làm thuốc hoặc làm dung môi trong tổng hợp hữu cơ.
3. Nhiên liệu và môi trường
Để giảm bớt tác hại của khí thải với môi trường, bên cạnh việc tăng hiệu suất đốt cháy, người ta còn đưa chất xúc tác vào ống xả của động cơ.
Nếu chưa hiểu - hãy xem: => Lời giải chi tiết ở đây
Nội dung quan tâm khác
Thêm kiến thức môn học
Giải bài tập những môn khác
Giải sgk lớp 11 KNTT
Giải sgk lớp 11 CTST
Giải sgk lớp 11 cánh diều
Giải SBT lớp 11 kết nối tri thức
Giải SBT lớp 11 chân trời sáng tạo
Giải SBT lớp 11 cánh diều
Giải chuyên đề học tập lớp 11 kết nối tri thức
Giải chuyên đề toán 11 kết nối tri thức
Giải chuyên đề ngữ văn 11 kết nối tri thức
Giải chuyên đề vật lí 11 kết nối tri thức
Giải chuyên đề hóa học 11 kết nối tri thức
Giải chuyên đề sinh học 11 kết nối tri thức
Giải chuyên đề kinh tế pháp luật 11 kết nối tri thức
Giải chuyên đề lịch sử 11 kết nối tri thức
Giải chuyên đề địa lí 11 kết nối tri thức
Giải chuyên đề mĩ thuật 11 kết nối tri thức
Giải chuyên đề âm nhạc 11 kết nối tri thức
Giải chuyên đề công nghệ chăn nuôi 11 kết nối tri thức
Giải chuyên đề công nghệ cơ khí 11 kết nối tri thức
Giải chuyên đề tin học 11 định hướng Khoa học máy tính kết nối tri thức
Giải chuyên đề tin học 11 định hướng Tin học ứng dụng kết nối tri thức
Giải chuyên đề quốc phòng an ninh 11 kết nối tri thức
Giải chuyên đề hoạt động trải nghiệm hướng nghiệp 11 kết nối tri thức
Giải chuyên đề học tập lớp 11 chân trời sáng tạo
Giải chuyên đề học tập lớp 11 cánh diều
Trắc nghiệm 11 Kết nối tri thức
Trắc nghiệm 11 Chân trời sáng tạo
Trắc nghiệm 11 Cánh diều
Bộ đề thi, đề kiểm tra lớp 11 kết nối tri thức
Đề thi Toán 11 Kết nối tri thức
Đề thi ngữ văn 11 Kết nối tri thức
Đề thi vật lí 11 Kết nối tri thức
Đề thi sinh học 11 Kết nối tri thức
Đề thi hóa học 11 Kết nối tri thức
Đề thi lịch sử 11 Kết nối tri thức
Đề thi địa lí 11 Kết nối tri thức
Đề thi kinh tế pháp luật 11 Kết nối tri thức
Đề thi công nghệ cơ khí 11 Kết nối tri thức
Đề thi công nghệ chăn nuôi 11 Kết nối tri thức
Đề thi tin học ứng dụng 11 Kết nối tri thức
Đề thi khoa học máy tính 11 Kết nối tri thức
Bộ đề thi, đề kiểm tra lớp 11 chân trời sáng tạo
Bộ đề thi, đề kiểm tra lớp 11 cánh diều
Đề thi Toán 11 Cánh diều
Đề thi ngữ văn 11 Cánh diều
Đề thi vật lí 11 Cánh diều
Đề thi sinh học 11 Cánh diều
Đề thi hóa học 11 Cánh diều
Đề thi lịch sử 11 Cánh diều
Đề thi địa lí 11 Cánh diều
Đề thi kinh tế pháp luật 11 Cánh diều
Đề thi công nghệ cơ khí 11 Cánh diều
Đề thi công nghệ chăn nuôi 11 Cánh diều
Đề thi tin học ứng dụng 11 Cánh diều
Đề thi khoa học máy tính 11 Cánh diều

Bình luận